Absolut toate substanțele sunt alcătuite din atomi, dar în majoritatea cazurilor aceștia nu plutesc doar separat, ci formează anumite legături. Scopul lor principal este de a obține cea mai stabilă stare. Toate sistemele se străduiesc să atingă echilibrul — legea de bază a universului. În chimie și fizică, aceasta are o mare importanță și caracterizează multe procese care au loc la nivel molecular.
Legăturile atomice pot fi de diferite tipuri și pot avea proprietăți diferite. Un exemplu sunt două elemente precum grafitul și diamantul. Ambele sunt carbon, dar din cauza naturii relației lor chimice, prezintă caracteristici materiale complet diferite.
Tipuri de legături chimice

Studiul compușilor atomici este o sarcină destul de necesară, cu ajutorul căreia se poate rezolva întrebarea referitoare la modul în care atomii interacționează între ei și la ce duce aceasta. Cunoștințele sunt adesea utilizate în metalurgie, industria chimică, medicină etc. La urma urmei, cu cât legătura atomică este mai puternică, cu atât este mai mare tensiunea necesară pentru a mări spațiul dintre atomi și, prin urmare, cu atât este mai mare modulul de elasticitate.
Acum se cunosc șase tipuri de legături atomice: metalică, covalentă, ionică, cu hidrogen, cu doi electroni și trei centri, Van der Walsa. Dar cele mai comune sunt:
- Covalentă — se formează atunci când electronii de valență ai unui atom sunt împărțiți între doi sau mai mulți atomi specifici. Acesta poate fi polar și nepolar. Covalent se găsește de obicei în moleculele organice pe bază de carbon. Mulți polimeri sunt de acest tip. Un exemplu de legătură covalentă este formarea moleculelor de apă;
- o legătură atomică metalică este cea care se formează atunci când electronii de valență nu sunt legați de un anumit atom sau ion, ci există ca un fel de „nor” de electroni în jurul centrelor ionice;
- ionic. Se formează atunci când electronii de valență sunt transferați de la o particulă la alta, formând un înveliș electronic exterior. O legătură se formează între ioni cu sarcini opuse. Un exemplu tipic poate fi considerată o sare. În general, materialele ionice sunt foarte fragile, deși există forțe destul de puternice între doi ioni.
Caracteristici ale legăturilor atomice
Forța tipurilor de legături dintre doi atomi crește odată cu creșterea numărului de perechi de electroni. Dar, pe lângă specii, există diferite tipuri ale acestora: primare și secundare. Cele primare formează relații chimice care țin particulele împreună. Cele secundare, pe de altă parte, sunt considerate elemente mai slabe. Secundarii pot include hidrogenul și van der Waals.
Există trei moduri diferite în care electronii externi pot forma o legătură:
- electronii pot fi transferați de la o particulă la alta;
- electronii pot fi împărțiți între atomi învecinați;
- pot fi împărțiți de toți atomii dintr-un material.
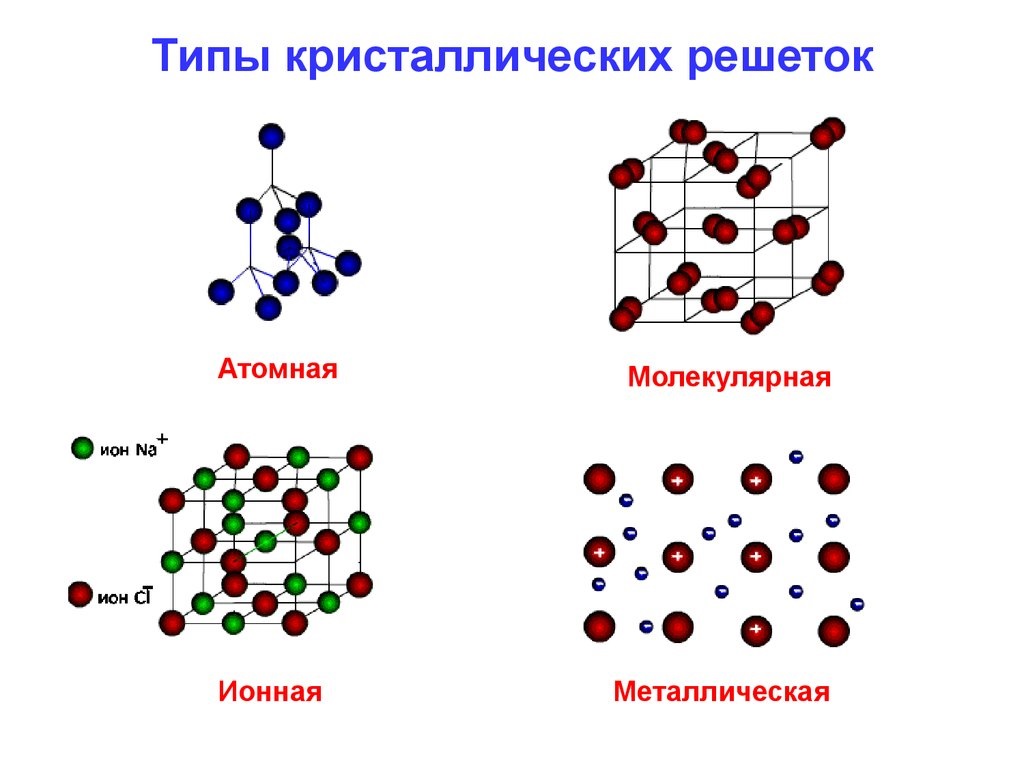
Rezultatele acestor metode pot fi observate în exemplul legăturii atomice a sodiului. Atomul are un singur electron în orbitalul exterior, dar îl dă altuia pentru a umple gaura din învelișul clorurii folosind prima metodă. Odată ce acest lucru se întâmplă, atomului de sodiu îi va lipsi un electron. Din acest motiv, acesta va avea o sarcină pozitivă și va deveni un ion de sodiu.
Simultan, atomul de clor, care a câștigat un electron suplimentar, va dobândi o sarcină negativă și va deveni un ion de clor. Forța electrică dintre aceste elemente cu sarcină opusă se va atrage, legându-le între ele. Compusul rezultat va fi format din cristale cubice solide, care sunt cunoscute și sub denumirea de sare de masă obișnuită.
Acum știți ce tipuri de legături au atomii în general, precum și principalele moduri în care acestea se formează.