Reducerea carbonothermică a siliciului este cea mai importantă reacție într-o mare varietate de procese. Astfel, reacția de reducere a siliciului prin carbon este una dintre reacțiile principale în producția de fontă brută de turnătorie și de refacere, în topirea oțelului în cuptoare acide și în producția multor feroaliaje, inclusiv a celor cu conținut scăzut de siliciu, astfel încât reducerea sa prin carbon a fost studiată în detaliu de către lucrătorii din furnale înalte și de către siderurgiști. O atenție deosebită a fost acordată problemelor legate de reducerea siliciului în lucrările legate de producția de feroaliaje. În producția de fontă brută și în topirea carbotermală a feroaliajelor, cum ar fi ferromanganul cu conținut ridicat de carbon, ferocromul cu conținut ridicat de carbon și altele, reducerea siliciului este descrisă prin reacția SiO2 + 2C(gr) = [Si]Me + 2CO.
Desăvârșirea procesului în diferite condiții de temperatură de punere în aplicare a acestuia depinde, de obicei, de activitatea siliciului în fluxul de minereu sau în topitura de zgură și de activitatea siliciului în metal. Într-o serie de cazuri, în special în topirea fontei brute și a feroaliajelor cu conținut ridicat de carbon, procesul se realizează în detrimentul carbonului dizolvat în metal. În aceste condiții, procesele de reducere a siliciului pot fi influențate semnificativ de activitatea carbonului din metal. În producția carbonatermică de siliciu, feroaliaje silicioase și carburi, agentul de reducere este carbonul liber. Sursa de siliciu în astfel de producție este cuarțul pur sau cuarțitul cu conținut ridicat de siliciu (> 97 %). Datorită faptului că solubilitatea carbonului în siliciu este scăzută, iar siliciul este insolubil în siliciu, reducerea SiO2 în aceste condiții este descrisă de reacția SiO2(t, g) + 2C =Si(ж)+ 2CO.
Această reacție a făcut obiectul unor discuții detaliate în manuale, monografii și articole de revistă. Ca urmare, s-a stabilit cu certitudine că, în ceea ce privește feroaliajele silicioase, reacția SiO2(t, g) + 2C =Si(ж)+ 2CO descrie doar stoechiometria procesului. Reducerea siliciului prin carbon se desfășoară conform unei scheme complexe, cu formarea de compuși intermediari gazoși și condensați. Cu toate acestea, motivele, precum și condițiile și factorii care contribuie la o astfel de dezvoltare a procesului, fără a menționa caracteristicile sale cantitative și calitative, nu sunt încă clare. Pe de altă parte, mecanismul de reducere a siliciului în sine nu este încă general recunoscut. Potrivit unor autori, produsul final — siliciul apare ca urmare a disproporționării oxidului său prin reacția 2SiO(Г) = Si( ж) + SiO2, alții observă posibilitatea disocierii la temperaturi înalte a carburii sale, alții cred că siliciul este un produs al distrugerii carburii de către siliciu. Între timp, numai cu o înțelegere adecvată a mecanismului proceselor este posibil să se obțină performanțe tehnice și economice ridicate de topire, astfel încât se face o încercare de evaluare nu numai calitativă, ci și cantitativă a recuperării de siliciu, inclusiv luând în considerare particularitățile aliajelor de topire cu conținutul său diferit.
Constanta de reacție a SiO2(t, g) + 2C =Si(ж)+ 2CO în conformitate cu legea maselor de acțiune poate fi descrisă prin ecuația
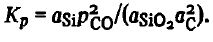
Aceasta pentru temperaturile de producere a feroaliajelor folosind expresia cunoscută — RTlnKp — ΔG 0Tși ecuațiile energiei Gibbs
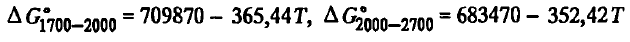
pot fi găsite respectiv din ecuațiile
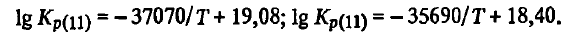
Din ecuațiile energiei și constantei Gibbs, rezultă că reacția SiO2(t, g) + 2C =Si(ж)+ 2CO este o reacție endotermică tipică. Astfel de reacții sunt caracterizate de o scădere a energiei Gibbs odată cu creșterea temperaturii și de o creștere a constantei. Reacția SiO2(t, g) + 2C =Si(ж)+ 2CO spre reducerea siliciului va fi termodinamic posibilă după ce energia Gibbs devine negativă ( ΔG 0 T < 0), а константа Kp =1,0. В связи с тем, что в реакции SiO2(t, g) + 2C =Si(ж)+ 2CO sunt substanțe pure, iar siliciul atât cu al doilea produs de reacție, cât și cu substanțele inițiale (SiO2, C) nu formează soluții, aSiO2 = 1, aC = 1, aSi= 1, aKp(SiO2(t, g) + 2C =Si(ж)+ 2CO) = p 2 CO. În aceste condiții, reducerea este posibilă numai atunci când pCO(SiO2(t, g) + 2C =Si(ж)+ 2CO) va depăși presiunea externă. Din ecuațiile energiei Gibbs, constantei de reacție, este ușor de găsit temperatura peste care reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) se poate desfășura în direcția producerii siliciului. În acest scop, este necesar să se ia respectiv ΔG 0 T =0, Kp(SiO2(t, w) + 2C =Si(w)+ 2CO)) = 1, pCO = 101,325 kPa. Rezolvând ecuațiile, se obține că reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) devine termodinamic posibilă la T > 1942 K. Această temperatură este denumită în mod obișnuit de producătorii de feroaliaje „temperatura teoretică de debut a reacției”. Într-adevăr, la această temperatură, echilibrul pentru reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) presiunea pCO(SiO2(t, g) + 2C =Si(ж)+ 2CO) devine egală cu presiunea atmosferică, iar la temperaturi mai ridicate o depășește. Aceasta din urmă rezultă în mod convingător din rezultatele calculelor prezentate mai jos:
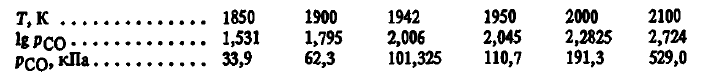
Se poate observa că la temperaturi cu 50-100 K peste temperatura teoretică de debut a reacției, presiunea de eliberare pCO(SiO2(t, g) + 2C =Si(ж)+ 2CO) va fi de 1,9-3 ori mai mare decât presiunea atmosferică. Prin urmare, reacția de SiO2(t, g) + 2C =Si(ж)+ 2CO este posibilă din punct de vedere termodinamic atunci când substanțele inițiale sunt încălzite > 1942 K, iar la temperaturi mai mari de 50-100 K ar trebui să se desfășoare cu viteză mare. Cu toate acestea, studiul produselor interacțiunii dintre SiO2 cu carbonul, precum și studiul vitezei de reacție (SiO2(t, g) + 2C =Si(ж)+ 2CO) a arătat că, chiar și la o temperatură cu 100K mai mare decât temperatura teoretică de declanșare, aceasta din urmă se desfășoară extrem de lent, iar siliciul nu este detectat în produsele sale. Una dintre explicațiile pentru discrepanța dintre aceste rezultate și experiență poate fi precizia insuficientă a datelor termodinamice. În favoarea acestei explicații este faptul că, în ultimii 20 de ani, proprietățile termodinamice ale SiO2 au fost ajustate. În acest sens, am verificat experimental fiabilitatea calculelor folosind ecuațiile de mai sus ale energiei Gibbs a reacției (SiO2(t, g) + 2C =Si(ж)+ 2CO).
Dacă analizăm cu atenție rezultatele calculelor presiunii pCO pentru reacția SiO2(t, g) + 2C =Si(ж)+ 2CO, se poate observa că chiar și o mică modificare a temperaturii este însoțită de modificări semnificative ale presiunii pCO. Astfel, atunci când temperatura din cuptor scade cu 58 K (de la 2000 la 1942 K), presiunea de echilibru pCO scade cu 90 kPa sau, în medie, cu 1,55 kPa pentru fiecare 1 K. În mod similar, atunci când temperatura cuptorului scade de la 1942 la 1900 K, presiunea de echilibru pCO(SiO2(t, g) + 2C =Si(ж)+ 2CO) scade în medie cu 1 kPa pentru fiecare grad de schimbare a temperaturii în cuptor. Acest lucru ne permite să estimăm experimental cu mare precizie temperatura de început a reacției. Dacă siliciul este plasat în cuptor și la 1942 K se creează în el o presiunepCO= 101,3 kPa, iar apoi se reduce temperatura cu numai 2 K (la 1940 K), atunci datorită faptului că presiunea de echilibru (la 1940 K pCO(SiO2(t, g) + 2C =Si(ж)+ 2CO) = 99 kPa) va fi cu 2,3 kPa mai mică decât cea reală, monoxidul de carbon va oxida siliciul prin reacția inversă (SiO2(t, g) + 2C =Si(ж)+ 2CO) până când presiunea pCO în cuptor scade cu 2,3 kPa. O astfel de modificare a pCO este ușor detectată chiar și de un manometru cu sensibilitate redusă, de exemplu un manometru cu mercur. Studiile au arătat că la p = 101,3 kPa oxidarea începe la 1670 °C. Acest lucru confirmă în mod convingător că datele termodinamice utilizate în calcule descriu cu suficientă acuratețe interacțiunea siliciului prin reacție (11). Aceasta indică, de asemenea, că pentru a obține siliciu prin reacție (SiO2(t, g) + 2C =Si(ж)+ 2CO) la temperaturi cu 50- 100 K peste temperatura teoretică de declanșare a acesteia (1942 K) nu este posibilă din motive legate atât de proprietățile substanțelor inițiale și obținute, cât și de particularitățile proceselor care au loc în timpul reducerii. Astfel de factori sunt adesea citați, cum ar fi faptul că siliciul, chiar și la temperaturi cu 200 K peste Tлп are o vâscozitate excepțional de mare (∼10 4 Pa⋅s). La o vâscozitate ridicată a lichidului SiO2 rata interacțiunii sale directe cu carbonul prin reacție (SiO2(t, g) + 2C =Si(ж)+ 2CO) este mică. Aceasta este limitată de viteza de difuzie a substanțelor la suprafața agentului de reducere și de viteza de eliminare din zona de reacție a unuia dintre produse — siliciul.
Într-adevăr, reducerea siliciului este mult mai ușoară dacă se realizează în prezența unui solvent care îl îndepărtează din zona de reacție, cum ar fi fierul. Siliciul formează siliciuri cu fierul: Fe2Si, FeSi, Fe2Si5Fe5Si3și FeSi2 — cu degajarea unei cantități importante de căldură. Astfel, entalpia de formare a monosilicidului și disilicidului din elemente este atât de semnificativă încât căldura eliberată este suficientă pentru a le încălzi cu 1000-1200 K. Ca urmare, reducerea siliciului devine posibilă la o temperatură mai mică decât cea a reacției (SiO2(t, g) + 2C =Si(ж)+ 2CO), temperaturi. Formarea siliciurilor, precum și dizolvarea siliciului, este însoțită de o scădere a activității acestuia, astfel încât, în termeni generali, constanta de reacție (SiO2(t, g) + 2C =Si(ж)+ 2CO) în prezența fierului poate fi scrisă ca Kp = p 2 COaSi Din această ecuație, după logaritmizare și înmulțire c u-RT, este ușor de estimat energia Gibbs a reacției (SiO2(t, g) + 2C =Si(ж)+ 2CO) în prezența fierului. Aceasta este descrisă de ecuația
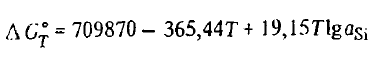
Din această ecuație rezultă că, datorită scăderii aSi temperatura teoretică de debut a reacției SiO2(t, g) + 2C =Si(ж)+ 2CO în prezența fierului scade simțitor. În funcție de concentrație, aceasta variază după cum urmează:
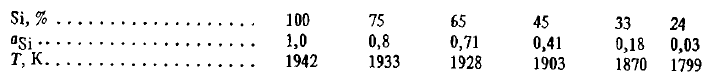
Cu toate acestea, experimentele arată că, în condiții de laborator, nu este posibil să se obțină nu numai siliciu, ci și aliaje care conțin 50-60 % Si. Pentru a afla motivele acestui fapt, precum și pentru a evalua corect factorii care afectează reducerea siliciului și mecanismul său, este necesar să se ia în considerare toate procesele care au loc în timpul reducerii într-un complex. După cum arată numeroase studii, reducerea siliciului prin carbon poate avea loc împreună cu reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) de asemenea prin reacții:
Nu este dificil de observat că în cursul reducerii prin reacții
se formează noi substanțe condensate și gazoase, care pot interacționa atât cu substanțele inițiale, cât și între ele. Prin urmare, condițiile de reducere a siliciului prin reacție (SiO2(t, g) + 2C =Si(ж)+ 2CO) pot fi influențate nu numai de reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) și (SiO2(t, g) + C(T) =SiO(Г)+ CO), dar și un întreg grup de reacții concomitente. Pentru a găsi toate reacțiile concomitente posibile, este necesar să se ia în considerare interacțiunea produselor de reacție în perechi
între ele și cu substanțele inițiale — siliciu și carbon. Luând în considerare faptul că dioxidul de carbon la T>1273 K este instabil, este suficient să luăm în considerare interacțiunea dintre: 1) SiO2 — Si; 2) SiO2 — SiC; 3) SiO(Г) — C; 4) SiO(Г) — SiC; 5) Si-C. Nu este greu de observat că în primul, al patrulea și al cincilea sistem este posibilă o singură reacție. Echilibrul în al doilea și al treilea sistem este descris de două reacții în fiecare. În consecință, atunci când se analizează echilibrul celor trei reacții de bază.
următoarele șapte reacții trebuie luate în considerare suplimentar:
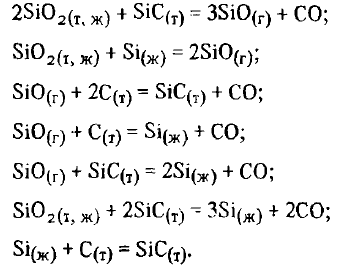
Să considerăm succesiv atât reacțiile principale, cât și cele asociate.
Reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO). Produsele de interacțiune ale acestei reacții sunt carbura solidă și monoxidul de carbon gazos. Energia Gibbs a reacției (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) și constanta sa în regiunea de temperatură 1700-2000 K pot fi găsite din ecuațiile
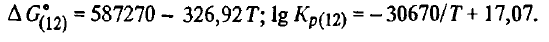
Din aceste ecuații se poate observa că reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), precum și (SiO2(t, g) + 2C =Si(ж)+ 2CO), este una endotermă tipică. Energia sa Gibbs scade odată cu creșterea temperaturii, în timp ce valoarea constantei, dimpotrivă, crește. În timpul reacției (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), precum și SiO2(t, g) + 2C =Si(ж)+ 2CO), se formează un singur produs gazos (CO). Prin urmare, pentru a caracteriza cursul acestei reacții, putem utiliza, ca și mai devreme pentru reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO), temperatura teoretică de început a reacției și presiunea gazului format, care pot fi estimate din ecuația lg pCO = -15335/T + 10,54, kPa. Luând în consecință ΔG 0 T = 0, Kp(SiO2(t, w) + 3C(T) =SiC(T)+ 2CO) = 1 și pCO = 101,3 kPa, constatăm că temperatura teoretică de debut a reacției (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) va fi de numai 1796 K, sau cu 146 K mai mică decât această temperatură pentru reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO). Aceasta înseamnă că dacă reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) se desfășoară cu o viteză mare, apoi, în momentul în care amestecul ajunge la temperatura de debut a reacției (SiO2(t, g) + 2C =Si(ж)+ 2CO) tot carbonul ar fi fost consumat pentru reducerea SiO2 prin reacția SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), și reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) ar fi imposibilă ca urmare a absenței sale simple. Cu toate acestea, în condiții reale, reducerea prin reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) ca rezultat al reacției (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) este complicată nu numai de consumul de agent reducător. Pentru a afla acești factori, calculăm presiunea de echilibru pCO(SiO2(t, w) + 3C(T) =SiC(T)+ 2CO). Rezultatele acestor calcule se compară cu presiunea parțială de echilibru pCO(SiO2(t, w) + 2C =Si(w)+ 2CO) sunt prezentate mai jos:
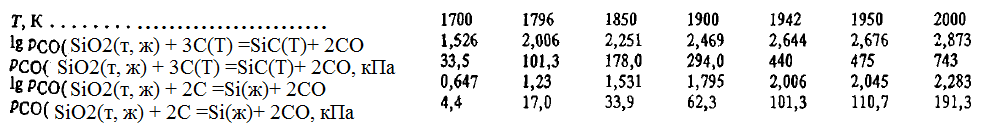
Presiunea pCO asupra carburii este semnificativ mai mare decât presiunea de echilibru cu siliciul prin reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO). Astfel, la 1796 K presiunea pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) = 6pCOSiO2(t, g) + 2C =Si(ж)+ 2CO). La 1942 K această diferență scade, deși rămâne semnificativă: pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) ∼ 4,5pCOSiO2(t, g) + 2C =Si(ж)+ 2CO). Numai la T≈ 3200 K presiunea pCOSiO2(t, g) + 2C =Si(ж)+ 2CO) devine egală sau mai mare decât presiunea pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO). Aceasta înseamnă că faza gazoasă formată prin reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), va fi întotdeauna, cu excepția cazului la 3200 K, oxidantă față de siliciu. În același timp, aceasta înseamnă că atâta timp cât reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), este imposibil să se obțină siliciu. Dacă chiar prin reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) și vor exista acte de interacțiune, atunci siliciul format trebuie să fie oxidat de oxidul de carbon la o rată ridicată. Aceasta înseamnă, în cele din urmă, că atâta timp cât există carbon în sistem, siliciul, chiar și în condiții favorabile pentru reacție (SiO2(t, g) + 2C =Si(ж)+ 2CO) nu pot apărea condiții termodinamice (de exemplu, la T > 1942 K). Diferența semnificativă între presiunile parțiale pCO peste carbură și siliciu pur conduce la faptul că siliciul este fie oxidat de oxidul de carbon, fie interacționează cu carbonul liber pentru a forma carbură. Cu alte cuvinte, atât timp cât există carbon în sistem, siliciul este metastabil, iar reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) este o reacție metastabilă.
Presiunea pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), precum și presiunea pCOSiO2(t, g) + 2C =Si(ж)+ 2CO), depinde foarte puternic de temperatură. Astfel, la creșterea sa de la 1796 la 1850 K pCO crește în medie cu 1,47 kPa/K, de la 1750 la 1796 K — cu 0,89 kPa/K. Acest lucru face posibilă o verificare experimentală folosind aceeași procedură ca pentru reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) (spre oxidarea SiC). Aceasta a arătat că oxidarea carburii cu monoxid de carbon la pвн= 101,3 kNa începe la 1527 °C, ceea ce este în concordanță cu calculele. În concluzie, trebuie remarcat faptul că presiunea pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) depășește semnificativ și presiunea pCOSiO2(t, g) + 2C =Si(ж)+ 2CO) peste aliajele Fe-Si. De exemplu, pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) la 1906 K este de 3,1 ori mai mare decât în cazul aliajului cu 50 % Si. Numai pentru aliajele cu conținut de < 24 % Si давление pCOSiO2(t, g) + 2C =Si(ж)+ 2CO) depășește pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO). Reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) este similară cu reacția (SiO2(t, g) + 2C =Si(ж)+ 2CO) se desfășoară extrem de lent, ceea ce, împreună cu vâscozitatea ridicată a Si02, se explică prin blocarea suprafeței de reacție a agentului de reducere de către carbura formată. Prin urmare, faptul că pCO(SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) >> pCOSiO2(t, g) + 2C =Si(ж)+ 2CO), se pare că nu este singurul motiv pentru care siliciul nu este detectat la T = 2000-2050 K.
Reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) . Energia Gibbs și constanta de reacție în funcție de temperatură la 1700-2000 K sunt descrise de ecuațiile
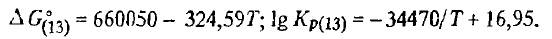
Din aspectul acestor ecuații, se poate presupune că reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO), precum și a reacției (SiO2(t, g) + 2C =Si(ж)+ 2CO) și (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), este o reacție endotermică tipică. Energia sa Gibbs scade odată cu creșterea temperaturii, iar la 2034 K își schimbă semnul în sens invers. Constanta Kp(SiO2(t, g) + C(T) =SiO(Г)+ CO), dimpotrivă, crește, iar la 2034 K este egală cu unitatea. Cu toate acestea, o examinare atentă a condițiilor de echilibru ale reacției (SiO2(t, g) + C(T) =SiO(Г)+ CO) arată că pentru aceasta temperatura la care energia Gibbs își schimbă semnul și Kp(SiO2(t, g) + C(T) =SiO(Г)+ CO) = 1, spre deosebire de reacțiile (SiO2(t, g) + 2C =Si(ж)+ 2CO) și (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), nu poate fi considerată ca o temperatură teoretică de debut a procesului. Pentru reacția (SiO2(t, g) + 2C(T) =SiO(Г)+ CO) la oSiO2= 1 și aC = 1 Kp(SiO2(t, g) + C(T) =SiO(Г)+ CO = pSiOpCOiar presiunea gazului eliberat, luând în considerare stoechiometria acestuia, este determinată de ecuația
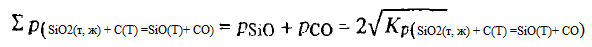
Din ecuație rezultă că la 2034 K Kp(SiO2(t, g) + C(T) =SiO(Г)+ CO ) poate fi egal cu unitatea numai atunci când pSiO = pCO = 1. Aceasta înseamnă, în primul rând, că în momentul în care ΔG 0 T = 0, ∑(pSiO + pCO)(SiO2(t, w) + C(T) =SiO(T)+ CO) va fi de două ori mai mare decât pвн , în al doilea rând, reacția (SiO2(t, g) + C(T) =SiO(T)+ CO) începe la Tvn = 101,3 kPa echilibrul său la TvnSiO și pCOmai mare de 50,65 kPa nu este realizat, iar Kp(SiO2(t, g) + C(T) =SiO(T)+ CO ) în aceste condiții nu poate depăși 0,25.
Pentru a găsi pentru reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) temperatura teoretică de debut, înlocuim în ecuația constantei valoarea lg Kp(SiO2(t, g) + C(T) =SiO(Г)+ CO ) = lg0,25 =-0602. Atunci Tn.r = 1964 K ΔG 0 (SiO2(t, g) + C(T) =SiO(G)+ CO ) va fi egal cu 23550 J/mol. Echilibrul reacției (SiO2(t, g) + C(T) =SiO(Г)+ CO) la temperaturi < 1964 К определяется монооксидом углерода, не только образующимся по реакции (SiO2(t, g) + C(T) =SiO(Г)+ CO), dar și conținute în atmosfera cuptorului, astfel încât compoziția de echilibru a gazelor la T ≤ 1964 K poate fi calculată din ecuațiile
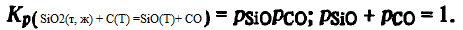
Rezolvând acest sistem împreună, găsim că
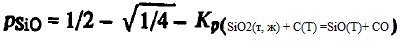
Rezultatele calculelor presiunii de eliberare ∑p(SiO2(t, g) + C(T) =SiO(Г)+ CO) și a presiunilor de echilibru pSiO și pCO sunt prezentate mai jos:

Din aceste date se poate observa că reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) este posibilă atunci când pSiO + pCO al gazului generat depășește presiunea externă, precum și atunci când pSiOdeterminată de constanta pSiO(SiO2(t, g) + C(T) =SiO(G)+ CO) = √ Kr(SiO2(t, w) + C(T) =SiO(G)+ CO)). depășește pSiO în atmosfera cuptorului. Primul caz este realizat la temperaturi > 1964 K, al doilea caz este posibil în principal la 1700-1964 K (< 1700 К равновесное pSiO(SiO2(t, g) + C(T) =SiO(Г)+ CO) este neglijabilă). Reacția din primul caz, aparent, poate avea loc atât în regim de difuzie, cât și în regim cinetic, iar viteza sa este determinată numai de viteza de aprovizionare a locului de reacție cu substanțe care reacționează.
În al doilea caz, reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) este realizată în condițiile pSiOvan > pSiOfact. În acest caz, se pare că reacția se desfășoară numai în modul difuzie, iar viteza sa depinde atât de viteza de furnizare a reactivilor, cât și de viteza de eliminare a produselor de reacție, formarea carburilor prin reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), aparent, nu poate împiedica reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO), deoarece la T < 1796К рCO(SiO2(t, g) + C(T) =SiO(Г)+ CO) peste presiunea pCO(SiO2(t, g) + C(T) =SiO(Г)+ CO), iar la 1796-1950 K faza gazoasă de echilibru conține mult mai puțin oxid de siliciu decât faza gazoasă formată în paralel cu aceeași rată de consum de SiO pentru reacțiile luate în considerare.2 pentru reacțiile luate în considerare. Aceasta din urmă poate fi observată în mod clar în figura 1, care compară compoziția gazului de echilibru și presiunea pSiO pentru reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO), precum și presiunea și compoziția gazelor prin reacție (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO). Consumul de siliciu pentru reacție [SiO2(t, g) + 3C(T) =SiC(T)+ 2CO se calculează din condiția de descreștere pentru o presiune la o temperatură dată pSiO de la pSiOpresiune = √ Kr(SiO2(t, w) + C(T) =SiO(G)+ CO)) la pSiOvan(SiO2(t, g) + C(T) =SiO(Г)+ CO). De exemplu, la 1900 K, presiunea de eliberare pSiOvan(SiO2(t, g) + C(T) =SiO(Г)+ CO) = √ Kr(SiO2(t, w) + C(T) =SiO(G)+ CO)) = 0,253, iar pSiOvan(SiO2(t, w) + C(T) =SiO(G)+ CO) = 0,0698. Se poate observa din curba 5 că pentru o modificare similară a compoziției gazelor din faza gazoasă eliberate prin reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) (pSiO = 0,253), este necesar să se reacționeze (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) utilizează 82,5 %, prin reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) — doar 17,5 % din SiO2iar pentru gazele formate la 1950 K — 50 % prin reacție (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), 50 % prin reacție (SiO2(t, g) + C(T) =SiO(Г)+ CO). Aceasta indică faptul că reacția (SiO2(t, g) + C(T) =SiO(Г)+ CO) are loc simultan cu alte procese, inclusiv reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO). Prin urmare, gazeificarea SiO2 în contrast cu reacția (SiO2(t, g) + 2C =Si(Ж)+ 2CO ) prin procesul de formare a carburilor prin reacția (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) nu este suprimat.
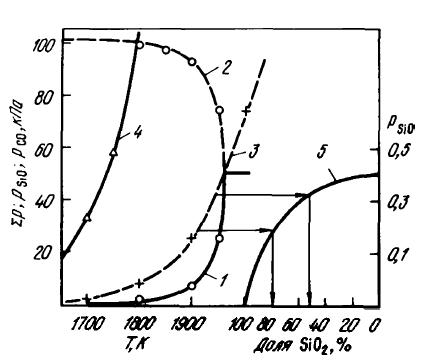
Figura 1. — Influența temperaturii asupra condițiilor de echilibru ale amestecului SiO2(t, g) + 3C(T) =SiC(T)+ 2CO și SiO2(t, g) + C(T) =SiO(T)+ CO:
3 — √ Kr(SiO2(t, w) + C(T) =SiO(T)+ CO)
ceea ce asigură că, dacă are loc simultan cu reacția de
SiO2(t, g) + C(T) =SiO(T)+ CO compoziția de echilibru a gazului
Reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) . Energia Gibbs și constanta de reacție (2SiO2(t, g) + SiC(T) =3SiO(Ж)+ CO) în funcție de temperatură sunt descrise de ecuațiile
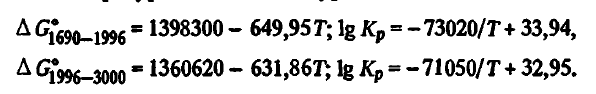
Din structura acestor ecuații rezultă că reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) este, de asemenea, endotermă. Energia sa Gibbs scade odată cu creșterea temperaturii și la 2155K își schimbă semnul, în timp ce constanta de reacție crește, iar la 2155 Kr(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) = 1. Cu toate acestea, pentru reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO), ca și pentru (SiO2(t, g) + C(T) =SiO(T)+ CO), această temperatură nu poate fi considerată ca fiind temperatura teoretică a debutului său, ceea ce se face uneori în mod eronat în literatura de specialitate. Energia Gibbs a reacției (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) devine negativ la pSiO + pCOp SiO , semnificativ mai mare decât cea atmosferică (176 kPa). Între timp, reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) este posibilă și atunci când pSiO + pCO depășește presiunea externă chiar și cu o fracțiune de kilopascal. În conformitate cu condițiile stoechiometrice ale reacției (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO), conținutul de SiO în faza gazoasă nu poate depăși 75 %. Apoi, luând în considerare faptul că pCO = 101,3-76,0 = 25,3 kPa, constanta de reacție (2SiO2(t, g) + SiC(T) =3SiO(Г)+ 2CO) în momentul atingerii echilibrului va fi egală cu Kp(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) = 0,75 3 ⋅ 0,25 = 0,1055; lg Kp(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) = -0,977, iar temperatura la care pSiO + pCO va fi egală cu 101,3 kPa, este determinată din egalitatea: -0,977 = -71050/T + 3295. Aceasta va fi egală cu 2094 K și trebuie considerată ca fiind temperatura teoretică de început a reacției (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO). La o temperatură mai mare de 2094 K, pSiO + pCO va depăși presiunea externă. Astfel, la 2100 K, presiunea pSiO + pCO în reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) va depăși presiunea externă cu aproximativ 10 kPa, în timp ce, pentru ca procesul să se desfășoare în direcția corectă, este suficient să se depășească presiunea cu zecimi de kilopascal. În consecință, reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+CO), precum și (SiO2(t, g) + C(T) =SiO(T)+ CO), este termodinamic posibil la temperaturi mult mai mici decât temperatura la care ΔG 02SiO2(t, g) + SiC(T) =3SiO(G)+ CO devine egală cu zero.
Pentru a evalua condițiile reacției (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO), calculăm pentru 1700-2200 K ∑p — presiunea gazelor la momentul emisiei, precum și compoziția lor de echilibru. Pentru a determina ∑p am utilizat un sistem de două ecuații, dintre care una este ecuația constantei Kp(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) = p 3 SiOpCO, cealaltă rezultă din stoichiometria sa pSiO =3pCO— Rezolvându-le împreună, găsim
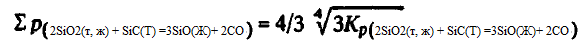
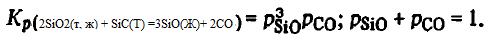
Rezultatele calculelor conform acestor ecuații sunt prezentate mai jos:
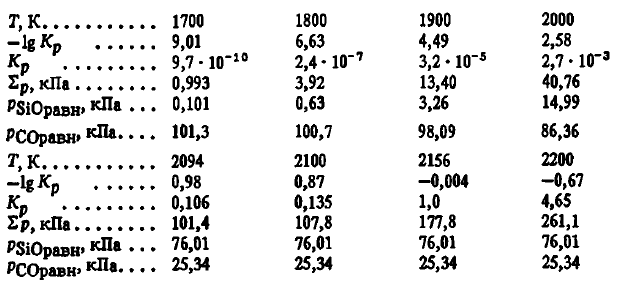
Compoziția gazelor la T < 2094 К определяется как реакцией (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) și compoziția gazelor din cuptor. Concentrația de SiO pe măsură ce reacția progresează (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) crește și atinge valoarea maximă (75 %) la 2094 K. Peste această temperatură, faza gazoasă deasupra sistemului SiO2-SiC la p = 101,3 kPa este caracterizată de un conținut constant de SiO (75 %) și CO (25 %). În consecință, reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) este posibil din punct de vedere termodinamic atât la temperaturi scăzute, cât și la temperaturi ridicate. Ea are loc cu o viteză apreciabilă la T > 1800 K. La T < 1800 К концентрация SiO(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) este mică. Condiția obligatorie pentru reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) la partea dreaptă este pSiOvan > pSiOfact. Aceasta înseamnă că la 1900 K reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) și compoziția gazelor din cuptor. Concentrația de SiO pe măsură ce reacția progresează (2SiO2(t, g) + SiC(T) =3) este posibilă în partea dreaptă numai în cazul în care pSiO în faza gazoasă va fi mai mic de 3,26 kPa, iar la 2000 K, dacă pSiOfact < 15,0 кПа. Однако скорость реакции (2SiO2(t, g) + SiC(T) =3SiO(Ж)+ CO) și compoziția gazelor din cuptor. Concentrația de SiO pe măsură ce reacția progresează (2SiO2(t, g) + SiC(T) =3) la T < 2094 К, по-видимому, невелика. Она будет определяться диффузионными процессами подвода реагентов в зону реакции и отвода из нее продуктов реакции.
Compararea compoziției de echilibru a gazului pentru reacțiile (SiO2(t, g) + C(T) =SiO(T)+ CO) și (2SiO2(t, g) + SiC(T) =3SiO(Ж)+ CO) (figura 2) ne permite să vedem că în regiunea 1800-2080 K pSiO(SiO2(t, g) + C(T) =SiO(T)+ CO) >> pSiO(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO). Aceasta înseamnă că prezența carbonului liber în sistem în această regiune de temperatură împiedică reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ 2CO) și, prin urmare, crește stabilitatea SiC. La T > 2080 K pSiO(2SiO2(t, g) + SiC(T) =3SiO(Г)+ 2CO)> pSiO(SiO2(t, g) + C(T) =SiO(Г)+ CO). În această regiune, compoziția gazelor este determinată numai de reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) și poate avea loc chiar și în prezența carbonului în sistem. La 2094 K, concentrația de SiO în gaze atinge un maxim și nu se modifică odată cu creșterea ulterioară a temperaturii în condițiile stoechiometriei reacției. În absența siliciului în sistem, în această regiune pSiO(2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO) >> pSiOfact. Prin urmare, carbura în prezența SiO2(Ж) este instabilă și reacționează intens prin reacția (2SiO2(t, g) + SiC(T) =3SiO(Г)+ CO).
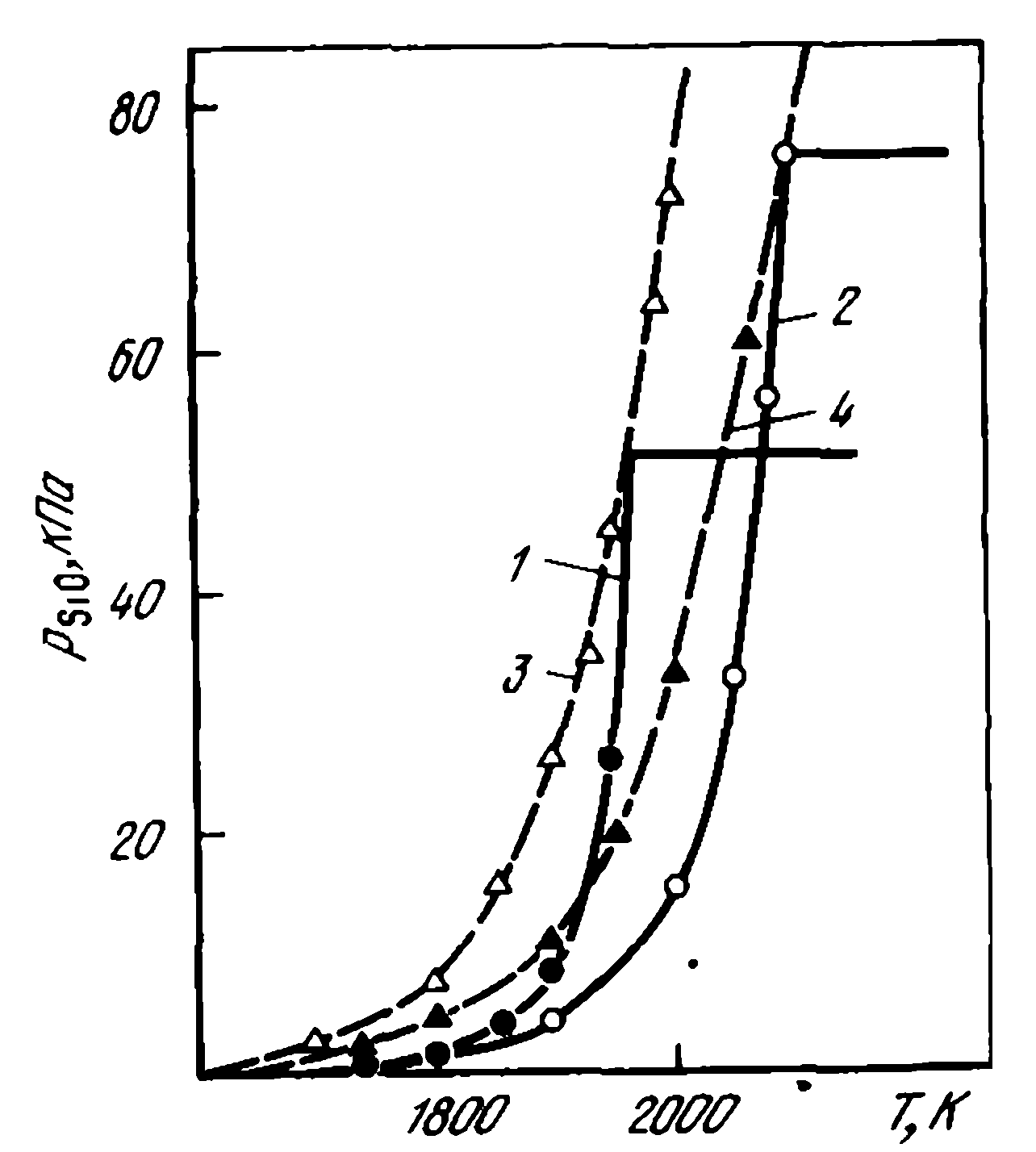
Figura 2. — Influența temperaturii asupra echilibrului pentru reacțiile
compoziția la momentul izolării (3,4)
Reacția (SiO2(t, g) + Si(Ж) =2SiO(Г)) . Energia Gibbs și constanta de reacție (SiO2(t, g) + Si(Ж) =2SiO(Г)) luând în considerare starea de agregare a SiO2 sunt descrise de ecuațiile
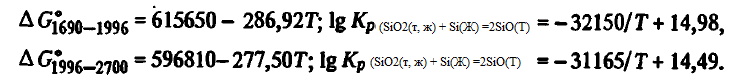
Din aceste ecuații rezultă că reacția (SiO2(t, g) + Si(Ж) =2SiO(Г)), precum și (SiO2(t, g) + 2C =Si(ж)+ 2CO) și (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO), este una endotermă tipică. Energia sa Gibbs scade odată cu creșterea temperaturii, iar constanta sa crește. La 2151 K, energia Gibbs a reacției (SiO2(t, g) + Si(Ж) =2SiO(T)) își schimbă semnul. La oSiO2, = 1 și aSi = 1, constanta sa Kr(SiO2(t, g) + Si(Ж) =2SiO(T)) = p 2 SiO. Informațiile privind valoarea lui Kr(SiO2(t, g) + Si(Ж) =2SiO(T)) și pSiOcalculate din această ecuație sunt prezentate mai jos:
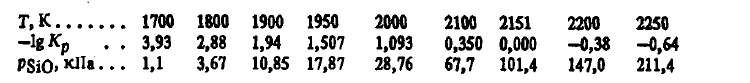
Din aceste date se poate observa că reacția (SiO2(t, g) + Si(Ж) =2SiO(Г)) începe la 1700 K. La această temperatură apare o cantitate notabilă de SiO în gaze. Posibilitatea reacției (SiO2(t, g) + Si(Ж) =2SiO(Г)) este determinată de presiunea parțială pSiO. Astfel, dacă la 1950K pSiO< 17,87 кПа, реакция (SiO2(t, g) + Si(Ж) =2SiO(Г)) va trece în partea dreaptă. Dacă presiunea pSiO> 17,87kPa, procesul este posibil numai în sens opus. La 2151 K, viteza de reacție a (SiO2(t, g) + Si(Ж) =2SiO(T) pare să crească puternic. Reacțiile (SiO2(t, g) + C(T) =SiO(T)+ CO) și (2SiO2(t, g) + SiC(T) =3SiO(Ж)+ 2CO) poate inhiba reacția (SiO2(t, g) + Si(Ж) =2SiO(T)), dar într-o regiune de temperatură foarte îngustă, 1930-2065 și, respectiv, 2090-2114 K. La T< 1930 К, в области 2065-2090 К и при T>2114 K, reacția (SiO2(t, g) + Si(Ж) =2SiO(T)) nu este suprimată de alte procese.
Reacția (SiO(Г) + 2C(Т) = SiC(T) +CO) . Energia Gibbs și constanta de reacție (SiO(Г) + 2C(Т) = SiC(T) +CO) la T>> 1700K sunt descrise de ecuații:
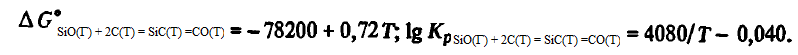
Reacția (SiO(Г) + 2C(Т) = SiC(T)=CO), spre deosebire de toate reacțiile examinate mai sus, este exotermă. Energia sa Gibbs crește odată cu creșterea temperaturii, iar constanta sa scade. Compoziția de echilibru a gazelor pentru reacția (SiO(Г) + 2C(Т) = SiC(T) +CO) pot fi găsite din ecuațiile.
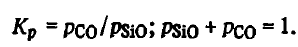
Rezolvându-le împreună, găsim

Din aceste date rezultă că reacția (SiO(Г) + 2C(Т) = SiC(T)+CO) este în mod excepțional puternic deplasată spre partea dreaptă la toate temperaturile. Aceasta este posibilă atât la temperaturi ridicate, cât și la temperaturi scăzute, până la temperatura camerei. Oxidul de siliciu gazos este utilizat aproape complet. Concentrația sa de echilibru la temperaturi scăzute este de miimi de procent. Utilizarea SiO la 2200-2300 K este ceva mai slabă. Chiar și așa, utilizarea SiO format prin reacția (2SiO2(t, g) + SiC(T) =3SiO(Ж)+ 2CO), poate depăși 97-98 %. Viteza de reacție (SiO(Г) + 2C(Т) = SiC(T) + CO), aparent, depinde numai de mărimea suprafeței de reacție a agentului de reducere și de viteza de retragere a produselor sale.
S-a observat mai sus că reacția (SiO(Г) + 2C(Т) = SiC(T) + CO) este exotermă. Ca urmare, produsele reacției — carbura și oxidul de carbon — sunt intens încălzite. Calculele arată că, dacă reacția implică SiO încălzit la 1000-1200 K, produsele sale sunt încălzite la 1650-1700 K. Prin urmare, reacția (SiO(Г) + 2C(Т) = SiC(T) + CO) nu numai că transformă reacția de suprafață (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) în masă, dar contribuie și la transferul unor cantități mari de căldură din zonele calde în zonele reci ale cuptorului.
Reacția (SiO(Г) + C(Т) = Si(Ж) +CO) . Energia Gibbs a reacției (SiO(Г) + C(Т) = Si(Ж) + CO) și constanta acesteia la 1690-3000 K sunt descrise de ecuațiile
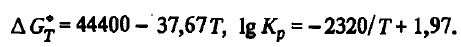
Din aceste ecuații se poate observa că reacția (SiO(Г) + C(Т) = Si(Ж) + CO) este endotermică. La 1178 K, energia Gibbs a reacției își schimbă semnul și devine negativă, iar Kr(SiO(Г) + C(Т) = Si(Ж) + CO) = 1. Pe această bază, mulți autori consideră că această temperatură este temperatura de debut a reacției (SiO(Г) + C(Т) = Si(Ж) + CO). Cu toate acestea, nu este cazul. Pentru a fi siguri de acest lucru, să calculăm echilibrul pentru reacția (SiO(Г) + C(Т) = Si(Ж) + CO) compoziția fazei gazoase. Aceasta va fi determinată din sistemul de ecuații

Din aceste date se poate observa că reacția (SiO(Г) + C(Т) = Si(Ж) + CO) la temperaturi scăzute este posibilă numai la valori uriașe pSiOceea ce este nerealist. Astfel, la 1178 K producția de siliciu este posibilă numai la pSiO > 50,6 kPa. La această temperatură, un pSiO niciuna dintre reacțiile luate în considerare mai sus nu asigură un p SiO atât de ridicat. După cum s-a indicat, presiunea p 0 SiO deasupra oxidului condensat este descrisă de ecuația
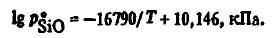
din care rezultă că la 1178 K echilibrul pentru tranziția de fază SiO(T) → SiO(r) presiune p 0 SiOeste de numai 7,8 mPa, care este de 6,5 până la 10,5 ori mai mică decât valoarea de echilibru pentru reacția (SiO(Г) + C(Т) = Si(Ж) =CO). Astfel, evaporarea de SiO(T) la temperaturi scăzute, inclusiv la 1178 K, nu asigură necesarul pentru reacția (SiO(Г) + C(Т) = Si(Ж)+ CO) presiunea pSiO. Numai la T> 1880 K presiunea parțială p 0 SiO depășește presiunea de echilibru pSiO(SiO(Г) + C(Т) = Si(Ж) + CO). Cu toate acestea, chiar și la T> 1880 K, reacția (SiO(Г) + C(Т) = Si(Ж) + CO) în condiții reale este imposibilă, metastabilă. Aceasta din urmă se datorează faptului că în prezența carbonului pSiO determinat de reacția (SiO(Г) + 2C(Т) = SiC(T) + CO), cu aproape un ordin de mărime mai mic decât echilibrul pSiO(SiO(Г) + C(Т) = Si(Ж) + CO). Astfel, la 2400K pSiO(SiO(Г) + C(Т) = Si(Ж) + CO) este de peste 4,2 ori mai mare decât pSiO(SiO(Г) + 2C(Т) = SiC(T) + CO). Numai la T >3184 K presiunea pSiO(SiO(Г) + C(Т) = Si(Ж) + CO) devine mai mare decât pSiO(SiO(Г) + 2C(Т) = SiC(T) + CO). Astfel, la 3200 K pSiO(SiO(Г) + C(Т) = Si(Ж) + CO) = 6,213 kPa, în timp ce pSiO(SiO(Г) + 2C(Т) = SiC(T) + CO) = 5,57 kPa. Prin urmare, siliciul devine o fază stabilă numai la T > 3184 K, iar reacția (SiO(Г) + 2C(Т) = SiC(T)+ CO), posibilă din punct de vedere termodinamic la temperaturi scăzute, în condiții reale este posibilă numai la T > 3184 K.
Reacția (SiO(Г) + SiC(Т) = 2Si(Ж) + CO) . Această reacție este una dintre cele mai importante reacții și determină în mare măsură toți parametrii procesului de reducere a siliciului. Energia Gibbs și constanta de reacție (SiO(Г) + SiC(Т) = 2Si(Ж) + CO) în intervalul de temperatură 1700-3000 K sunt descrise de ecuațiile
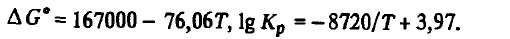
Din. aceste ecuații se poate observa că reacția (SiO(Г) + SiC(Т) = 2Si(Ж) + CO) este endotermă. Energia sa Gibbs scade odată cu creșterea temperaturii, iar constanta sa crește. La 2195 K energia Gibbs își schimbă semnul și peste 2195 K devine negativă, iar Kr(SiO(Г) + SiC(Т) = 2Si(Ж) + CO = 1 la 2195 K. Cu toate acestea, această temperatură pentru reacția (SiO(Г) + SiC(Т) = 2Si(Ж) + CO) nu poate fi în niciun caz identificată cu temperatura sa de debut. Pentru a ne asigura de cele de mai sus, să calculăm compoziția gazelor pentru reacția (SiO(Г) + SiC(Т) = 2Si(Ж) + CO). În mod similar cu reacțiile (SiO(Г) + 2C(Т) = SiC(T) +CO) și (SiO(Г) + C(Т) = Si(Ж) + CO), acest lucru se poate face folosind sistemul de ecuații
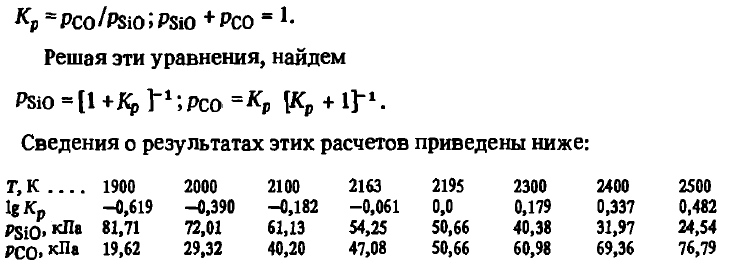
Se poate observa că reacția (SiO(Г) + SiC(Т) = 2Si(Ж)+ CO) este posibilă la orice temperatură la care o temperatură mai mare decât temperatura de echilibru pentru reacția (SiO(Г) + SiC(Т) = 2Si(Ж)+ CO), presiunea parțială a oxidului de siliciu în atmosfera cuptorului. Valoarea acestei presiuni depinde de temperatură. Astfel, la T ≤ 1900K pSiO(SiO(Г) + SiC(Т) = 2Si(Ж) + CO) depășește 80 kPa. Aceasta înseamnă că în acest caz distrugerea carburii poate avea loc numai prin faza gazoasă formată la T > 2114 K prin reacția (SiO2(t, g) + Si(Ж) =2SiO(T)). În consecință, distrugerea carburilor la 1900 K și sub această temperatură este posibilă numai datorită gazelor care se scurg din zonele cu temperatură ridicată ale cuptorului. Pe măsură ce temperatura crește, pSiO(SiO(Г) + SiC(Т) = 2Si(Ж) + CO) scade puternic. Cu toate acestea, chiar și la T > 2000 K, ea rămâne foarte ridicată. Astfel, în intervalul de temperatură de la 2000 la 2200 K, concentrația de echilibru a SiO fluctuează între 50-72 % și numai la T ≈ 2500 K scade la 25 %. Majoritatea autorilor, observând posibilitatea de distrugere a carburii prin reacția (SiO(Г) + SiC(Т) = 2Si(Ж) + CO), consideră acest proces ca fiind unul minor, deși la temperaturi ridicate se poate desfășura aparent cu o viteză mare.
Trebuie remarcat faptul că pentru reacția (SiO(Г) + SiC(Т) = 2Si(Ж)+ CO), schimbarea la 2195 K a semnului energiei Gibbs cu cel invers nu duce la schimbarea direcției acesteia. La această temperatură, numai egalitatea concentrațiilor de echilibru ale componentelor fazei gazoase (pSiO = pCO). Aceeași situație are loc și pentru reacția (SiO(Г) + C(Т) = Si(Ж) + CO) la 1178 k. În consecință, regula „o reacție este posibilă în partea dreaptă dacă energia sa Gibbs este negativă” trebuie utilizată cu prudență, luând în considerare structura constantei. Într-o serie de cazuri, reacția este posibilă pe partea dreaptă și la ΔG 0 pozitiv T . Astfel de reacții includ (SiO(Г) + C(Т) = Si(Ж) + CO), (SiO(Г) + SiC(Т) = 2Si(Ж) + CO), precum și SiO2(t, g) + C(T) =SiO(T)+ CO); 2SiO2(t, g) + SiC(T) =3SiO(Ж)+ 2CO și SiO2(t, g) + Si(Ж) =2SiO(T) .
Reacția (SiO2(T.ZH.) + 2SiC(Т) = 3Si(Ж) + 2CO) . Această reacție, precum și (SiO(Г) + SiC(Т) = 2Si(Ж) + CO), este o reacție de distrugere a carburilor. La 1700-3000 K, energia Gibbs și Cr(SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж) + 2CO) este descrisă de ecuațiile
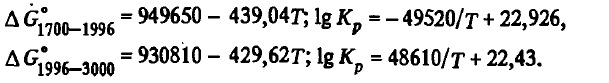
Din aceste ecuații se poate observa că reacția (SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж) + 2CO) este una endotermă tipică. Energia sa Gibbs scade odată cu creșterea temperaturii, își schimbă semnul la 2167 K, iar Kr(SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж) + 2CO), dimpotrivă, crește și la 2167 K este egală cu unu:
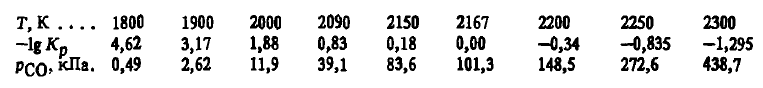
Din aceste date se poate observa că temperatura teoretică de început a reacției (SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж)+ 2CO) coincide cu temperatura la care pCO(SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж) + 2CO) devine egală cu presiunea externă. Distrugerea carburii de către siliciu la pвн =101,3 kPa are loc numai la temperaturi foarte ridicate. Atunci când presiunea cuptorului scade sub presiunea atmosferică, reacția (SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж) + 2CO) este termodinamic posibilă la temperaturi mai scăzute. Astfel, la p = 10,1 kPa, reacția este posibilă la T > 2000 K, iar la pвн < 1,0 кПа — чуть выше 1800 К. Подобное имеет место и в том случае, когда снижается только парциальное давление pCO, iar presiunea totală rămâne neschimbată. Cu toate acestea, rata mare de reacție (SiO 2 (T (G)) + 2SiC(Т) = 3Si(Ж) + 2CO) la o presiune externă egală cu presiunea atmosferică este posibilă numai la T >> 2167 K.
Reacția (Si(Ж) + C(Т) = SiC(Т)) . Aceasta este singura reacție în care substanțele inițiale și produsele sunt condensate. Energia și constanta Gibbs ale acestei reacții la 1690-3000 K pot fi găsite din ecuațiile
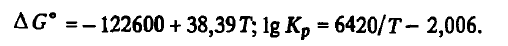
Din aceste ecuații rezultă că carbura este foarte stabilă. Formarea sa are loc cu degajarea unei cantități mari de căldură printr-o reacție exotermică. La aC = 1 și aSiC = 1 lg Kr(Si(Ж) + C(Т) = SiC(Т)) = -lgaSi. Aceasta înseamnă că ecuația constantei de reacție (Si(Ж) + C(Т) = SiC(Т)) poate fi utilizată pentru a determina activitatea siliciului în echilibru cu carbura și carbonul. Aceasta s-a dovedit a fi următoarea în funcție de temperatură:
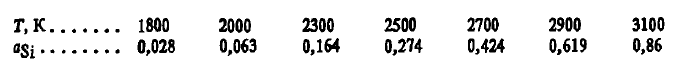
Aceasta înseamnă că, la temperaturi adecvate, carbura de siliciu va fi distrusă de orice metal în care activitatea siliciului este mai mică decât cea dată.
Astfel, în timpul reducerii SiO2 cu carbon, are loc un set complex de reacții atât în faza condensată, cât și în faza gazoasă. Majoritatea reacțiilor observate în reducerea siliciului sunt reacții endotermice și se desfășoară cu atât mai complet, cu cât temperatura este mai ridicată. Condițiile de echilibru ale reacțiilor principale și ale celor care însoțesc reducerea siliciului sunt determinate în mare măsură de natura și compoziția fazei gazoase. Compoziția fazelor gazoase formate în atmosfera cuptorului în timpul reducerii carbon-termice a siliciului se modifică continuu. Aceasta depinde de temperatura procesului și de compoziția fazelor condensate.
Figura 3 compară modificarea energiei Gibbs a reacției principale și a reacției însoțitoare considerate mai sus. Numerotarea acestora corespunde cu numerele curbelor. Punctele de pe curbe sunt temperaturile la care presiunea gazului atinge presiunea atmosferică, iar liniile punctate sunt regiunile de temperatură în care au loc efectiv procesele corespunzătoare. Analizele proceselor conform metodologiei acceptate de obicei (determinarea temperaturilor la care energia Gibbs își schimbă semnul) nu oferă date fiabile cu privire la procesele de reducere a siliciului prin carbon. Astfel, figura 3 arată că reacțiile
au loc la orice temperatură, în timp ce în analiza conform metodei general acceptate acestea sunt posibile doar la temperaturi ridicate (respectiv peste 2034, 2157 și 2151 K), iar reacția (SiO(Г) + SiC(Т) = 2Si(Ж) + CO) apare la topirea siliciului la T > 2090 K și la topirea aliajelor cu fier la T > 2000 K, în timp ce conform metodei convenționale (ΔG 0 T = 0) la T > 2167 K. Pe de altă parte, posibilitatea termodinamică a reacțiilor (SiO2(t, g) + 3C(T) =SiC(T)+ 2CO) și (SiO(Г) + SiC(Т) = 2Si(Ж) + CO) în zonele indicate de linia punctată la ΔG 0 T< 0, по-видимому, не реализуется. Все это свидетельствует в пользу того, что в таких сложных процессах, как восстановление кремнезема углеродом, термодинамический анализ можно использовать лишь совместно с изучением кинетики и анализом равновесия всего комплекса реакций.