Permanganatul de potasiu (permanganat de potasiu) KMnO4 este o sare a acidului manganic HMnO4. Densitatea KMnO4 este de 2,703 g/cm 3 , solubilitatea KMnO4 în apă la 20 °C-6,4 g la 100 g H2O, iar la 60 °C 22,2 g. Permanganatul de potasiu KMnO4 este un agent oxidant puternic. Când este amestecat cu H2SO4 concentrat (precum și cu glicerol și alte substanțe) se poate produce o explozie. KMnO4 — este o sare instabilă din punct de vedere termic, se descompune la încălzire >200 °C conform schemei
Rezultatele noilor studii privind disocierea termică a KMnO4 în curent de oxigen au arătat că procesul se desfășoară în două etape:
Cu efecte termice la 225 și 660 °C.
În mediu acid, KMnO4 Mn (VII) este redus la Mn (II), de exemplu MnSO4. Permanganatul de potasiu (KMnO4) ca sistem termodinamic deschis a fost analizat de A. A. Kabanov. A. Kabanov. Producția industrială de KMnO4 se bazează pe oxidarea electrolitică a K2MnO4[Mn (VI)] în KMnO4 [Mn (VII)]. În prima etapă a procesului tehnologic, K2MnO4prin încălzirea unui amestec de pirolusit cu o soluție de potasiu caustic (KOH) de 50% la 200-250 °C. Interacțiunea chimică a KOH cu MnO2 cu participarea oxigenului din aer este descrisă prin reacția
Aliajul conține 20-30 % H2MnO4. Apoi permanganatul de potasiu K2MnO4în care manganul este conținut sub formă de MnO4 2- , este levigat pentru a obține o soluție. În etapa următoare, anionul MnO4 2- este oxidat la MnO2. Acest proces este descris prin schema
KOH format la catod se separă de KMnO prin centrifugare, se evaporă și se întoarce în ciclul de reciclare.4este evaporat și reintrodus în ciclul de reciclare. Compoziția electrolitului la începutul (A) și la sfârșitul (B) electrolizei este caracterizată de următoarele date, g/l:

Produsul sintetizat KMnO4 este supus unor prelucrări succesive (dizolvare la 85 °C, cristalizare, centrifugare, uscare în vid, măcinare și cernere) pentru a obține manganul de potasiu comercial cristalin pur KMnO4. Caracterizarea generală a electrolizorului și a procesului este prezentată mai jos de V.V. Stender. Mai multe rânduri concentrice de anozi (foi de nichel și (sau) fier) sunt plasate în carcasa de oțel a electrolizorului (un cilindru cu diametrul de 2 m și înălțimea de 1 m, cu fundul conic). Spațiul dintre rândurile de anozi este de 100 mm. În aceste spații sunt amplasate rânduri concentrice de catozi (tije de fier cu diametrul de 20-25 mm). La proiectarea electrolizorului, se ia în considerare posibilitatea reducerii KMnO la catod, dacă densitatea de KMnO4 la catod, dacă densitatea curentului nu este suficient de mare comparativ cu densitatea curentului la anod. Numărul de tije catodice este ales astfel încât densitatea curentului la catod să fie de zece ori mai mare decât la anod. Acest lucru exclude posibilitatea reducerii manganului la catod prin reacție alcalină.
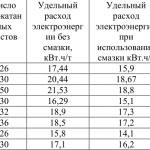
Densitatea curentului la anod este de 60-70 A/m 2 , la catod de 700 A/m 2 . Sarcina de curent pe baie este de 1200-1400 A, tensiunea pe baie la începutul procesului este de 2,7 V, iar la sfârșit de 8 V. Temperatura de electroliză este de 60-70 °C. Consumul specific de energie atinge 0,7-1,0 kWh pentru 1 kg KMnO4. Durata unui ciclu de electroliză este de 48 h. Cristale de KMnO4 cristalele au culoarea violet închis, iar soluțiile în apă au culoarea roșu-violet.
Aplicații ale KMnO4
În chimia analitică, soluțiile standard de KMnO4sunt utilizate pentru determinări volumetrice cantitative ale metalelor (analiză titrimetrică). Titrarea agenților reducători [Fe (II), Mn (II), Mo (III), Ti (III), O2 — etc.) cu soluție standard de KMnO4 se efectuează în mediu acid. Reacția de titrare în acest caz se desfășoară conform schemei
MnO4 — + 8H + + + 5e → Mn 2+ + 4H2O.
Al doilea grup de substanțe sunt sulfiții, sulfurile, tiosulfații etc., care se oxidează mai ușor în mediu neutru sau alcalin. Reacția este descrisă prin schema
În producția chimică, permanganatele sunt utilizate ca agenți oxidanți. Permanganatul de potasiu KMnO4 are o puternică proprietate dezinfectantă, ceea ce determină utilizarea sa largă în medicină.