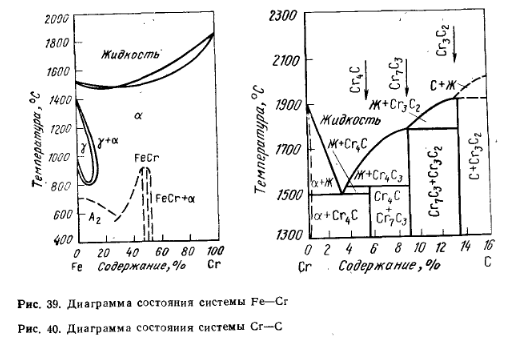
Cromul (de la cuvântul grecesc chroma — culoare) este un element de tranziție din grupa VI a sistemului periodic al elementelor lui D. I. Mendeleev, are structura electronică 1s 2 2s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 . Duritatea pe scara mineralogică este de 8,5. Este un metal alb-argintiu strălucitor cu următoarele proprietăți fizice și chimice: masa atomică 52,01; valența 1-6; densitatea 719 g/cm 3 ; punctul de topire 1855°C, punctul de fierbere 2469°C. Împreună cu fierul, cromul are solubilitate reciprocă completă în stare solidă și lichidă (Fig. 39) Punctul de topire al ferocromului cu conținut ridicat de carbon ~1500°C și 1600-1630°C cu conținut scăzut de carbon. Cu carbonul, cromul formează carburi puternice Cr23С6 (5,7 % C), Cr7С3 (9,01 % C) și Cr3С2 (13,34 % C), cu puncte de topire de 1520, 1780 și, respectiv, 1890 °C. Diagrama de stare a sistemului Cr — C este prezentată în Fig. 40. În sistemul Cr-Fe-C există carburi duble: (Cr, Fe)23C6; (Cr, Fe)7C3; (Cr, Fe)3C2.
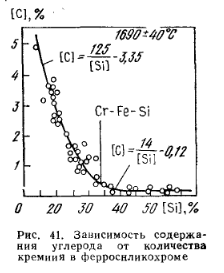
Ferocromul cu conținut ridicat de carbon conține carbon în principal sub formă de (Cr, Fe)7C3iar ferocromul rafinat conține carbon sub formă de (Cr, Fe)23C3. Cu siliciul, cromul formează o serie de siliciuri: Cr3Si (15,25 % Si); Cr5Si3 (24,45 % Si); CrSi (35,05 % Si); CrSi2 (51,9% Si), având puncte de topire de 1710, 1597, 1545 și, respectiv, 1550 C. Structura și proprietățile aliajelor lichide de crom cu siliciu sunt examinate de P. V. Geld. În sistemul ternar Fe-Cr-Si la 15 și 25 % Fe în aliaj se găsesc siliciuri (Cr, Fe) Si și (Cr, Fe) Si2. Primul aliaj cu 32-35 % Si se topește la 1500 °C, al doilea cu 52 % Si se topește la 1350-1400 °C. Ferrosilicochromul cu 60 % Si constă din siliciu și (Fe, Cr)Si2Si; cu 50 % Si — din (Fe, Cr) Si2Si; cu 40 % Si — din (Fe, Cr)Si2 și (Fe, Cr) Si; cu 30 % Si- din (Fe, Cr) Si și (Fe, Cr)3Si2; 20% Si- din (Fe, Cr)3Si2 n α-soluție. Atunci când siliciurile interacționează cu carbonul, apar fazele ternare MemSinCp. Siliciurile de crom sunt mai puternice decât carburile sale, astfel încât în aliajele Fe-Cr-Si conținutul de carbon scade odată cu creșterea conținutului de siliciu (fig. 41). Cu oxigenul, cromul formează o serie de oxizi (tabelul 63). Cel mai puternic oxid este Cr2O3Cromul se găsește în principal în minereuri și zgură. CrO se găsește, de asemenea, în zgură acidă, în special în procesele reductive. În zgurii cu conținut ridicat de var din procesele oxidante, CrO se formează parțial în procesele oxidante.3. Cromul cu sulf formează sulfuri CrS, Cr2Sз și CrзS4. Cu fosforul, cromul formează fosfuri Cr3P, Cr2P, CrP și CrP2. Cu azotul, cromul formează nitruri Cr2N și CrN. Cu creșterea temperaturii, rezistența termodinamică a nitrurilor scade. Punctul de topire Cr2N ~ 1700 ° C, CrN se disociază la 1500 ° C, densitatea lor fiind egală cu 6,5 și respectiv 6,18 g / cm 3 . Solubilitatea azotului în cromul lichid este de 4,2 % N la 1898 °C și 6,5 % N pentru topitura supraînghețată la 1600 °C. Dizolvarea azotului în crom scade semnificativ punctul său de topire. Cromul solid saturat cu azot la 800-1000 °C poate conține până la 21 % din acesta.

Ți-a plăcut articolul? Împărtășiți cu prietenii:
S-ar putea să vă intereseze și