Siliciul este un element chimic din grupa IV a sistemului periodic al elementelor al lui D.I. Mendeleev. A fost descoperit în 1811. A fost descoperit în 1811 de J. Gay-Lusac și L. Ternard. Numărul său de ordine este 14, masa atomică este 28,08, volumul atomic este 12,04 — 1 0-6 m 3 /mol. Siliciul este un metaloid și aparține subgrupului carbonului. Valența oxigenului său este +2 și +4. În ceea ce privește prevalența în natură, siliciul este al doilea după oxigen. Fracția sa masică în scoarța terestră este de 27,6 %. Potrivit lui V.I. Vernadsky, scoarța terestră este formată din siliciu și silicați în proporție de peste 97 %. Oxigenul și compușii organici ai siliciului fac parte și din plante și animale.
Siliciul produs artificial poate fi amorf sau cristalin. Siliciul amorf este o pulbere maro, fin dispersată, foarte higroscopică, care, conform datelor de difracție a razelor X, constă în cristale mici de siliciu. Acesta poate fi obținut prin reducerea la temperaturi ridicate a SiCl4 cu vapori de zinc.
Siliciul cristalin este de culoare gri oțel și are un luciu metalic. Densitatea siliciului cristalin la 20°C este de 2,33 g/cm 3 , a siliciului lichid la 1723-2,51, iar la 1903K — 2,445 g/cm 3 . Punctul de topire al siliciului este 1690 K, iar punctul de fierbere este 3513 K. Conform datelor, presiunea de vapori a siliciului la T = 2500÷4000 K este descrisă de ecuația lg pSi = -20130/ T + 7,736, kPa. Căldura de aprindere a siliciului este de 452610, de topire de 49790 și de vaporizare de 385020 J/mol.
Policristalele de siliciu se caracterizează prin duritate ridicată (la 20°C HRC = 106). Cu toate acestea, siliciul este foarte fragil, astfel încât are o rezistență ridicată la compresiune (σ SZh В ≈690 MPa) și o rezistență la tracțiune foarte scăzută (σВ ≈ 16,7 MPa).
La temperatura camerei siliciul este inert, reacționează numai cu fluorul, formând 81P4 volatil. Dintre acizi reacționează numai cu acidul azotic în amestec cu acidul fluorhidric. Cu alcalii, însă, siliciul reacționează destul de ușor. Una dintre reacțiile sale cu alcali
este utilizat pentru producerea hidrogenului. Împreună cu nemetalele, siliciul este capabil să producă un număr mare de compuși puternici din punct de vedere chimic. Printre acești compuși este necesar să menționăm halogenurile (de la SiX4 la SinX2n+2unde X este un halogen și n ≤ 25), compușii lor amestecați SiCl3B, SiFCl3 etc., oxiclorurile Si2OCl3Si3O2Cl3 etc., nitrurile Si3N4Si2N3, SiN și hidrurile cu formula generală SinH2n+2și a compușilor întâlniți în producția de feroaliaje — sulfurile volatile SiS și SiS2 și carbura refractară SiC.
Siliciul este, de asemenea, capabil să dea compuși cu metale — siliciuri, dintre care cele mai importante sunt siliciurile de fier, crom, mangan, molibden, zirconiu, precum și siliciurile REM și alcaline. Această proprietate a siliciului — capacitatea de a da compuși și soluții foarte puternice din punct de vedere chimic cu metalele — este utilizată pe scară largă în producția de feroaliaje cu conținut scăzut de carbon, precum și în reducerea metalelor alcalino-terestre cu fierbere ușoară (Ca, Mg, Ba) și a celor greu de recuperat (Zr, Al etc.).
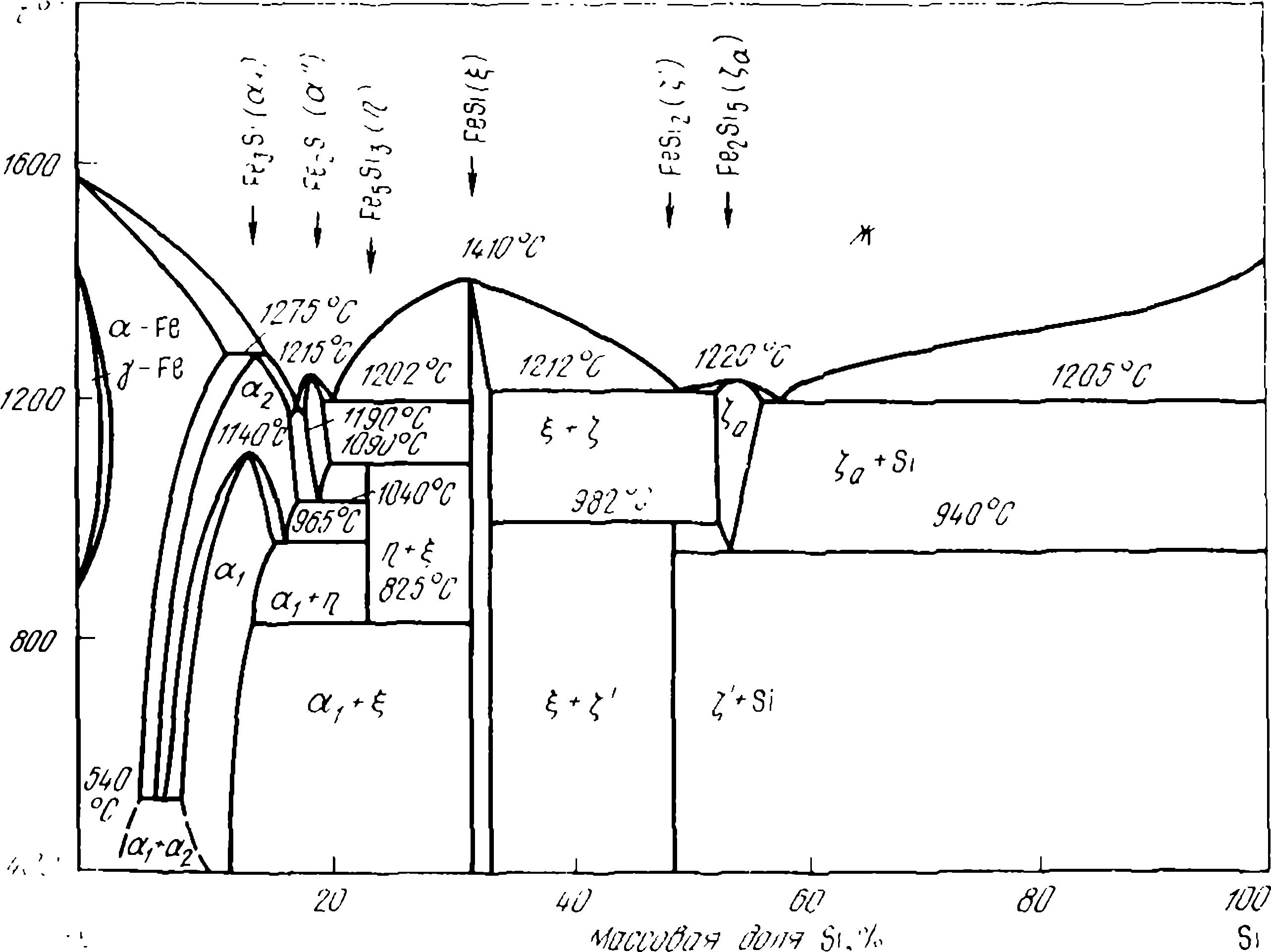
Aliajele de siliciu cu fier au fost studiate de P.V. Geld și școala sa, o atenție deosebită fiind acordată părții din sistemul Fe-Si referitoare la aliajele cu un conținut ridicat al acestuia. Acest lucru se datorează faptului că, așa cum se poate observa din diagrama Fe-Si (figura 1), în aliajele cu această compoziție au loc o serie de transformări, care afectează semnificativ calitatea ferosiliciului de diferite grade. Astfel, disiliciura de FeSi2 disiliciura este stabilă numai la temperaturi scăzute (< 918 или 968 °С, см. рисунок 1). При высоких температурах устойчива его высокотемпературная модификация — лебоит. Содержание кремния в этой фазе колеблется в пределах 53—56 %. В дальнейшем лебоит будем обозначать химической формулой Fe2Si5, care corespunde practic concentrației maxime de siliciu în leboită.
La răcirea aliajelor cu conținut > 55,5 % Si leboită la T < 1213 К разлагается по эвтектоидной реакции
Aliajele cu compoziție intermediară (50,15-55,5 % Si) suferă mai întâi la 1255 K transformări peritectoide (3) și apoi la 1213 K — eutectoide (2). Aceste transformări Fe2Si5 în reacțiile (2) și (3) sunt însoțite de modificări ale volumului de siliciură. O astfel de modificare este deosebit de mare în timpul reacției (2) — aproximativ 14 %, astfel încât aliajele care conțin leboită își pierd continuitatea, se fisurează și chiar se desfac. În cazul cristalizării lente, în echilibru (a se vedea figura 1), leboyita poate fi eliberată în timpul cristalizării aliajelor FS75 și FS45.
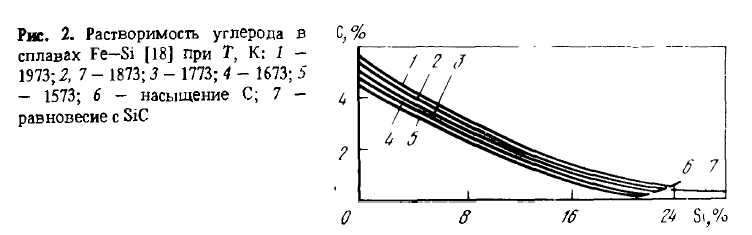
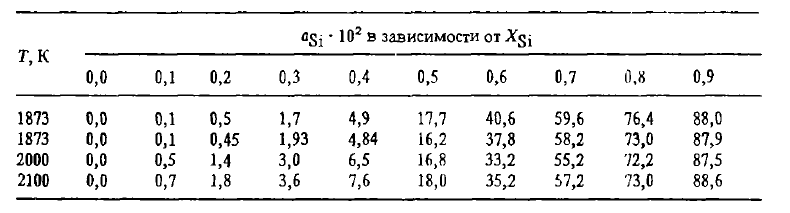
Cu toate acestea, fisurarea asociată cu descompunerea eutectoidală a leboyitei este doar una dintre cauzele desprinderii. Al doilea motiv, aparent cel principal, este acela că formarea fisurilor de-a lungul limitelor de granulație creează posibilitatea ca lichidele eliberate de-a lungul acestor limite — fosfor, arsenic, sulfuri și carburi de aluminiu etc. — să reacționeze cu umiditatea aerului în reacții care eliberează H2, PH3, PH4AsH4 etc., iar în fisuri — oxizi friabili Al2O3SiO2și alți compuși care le răspândesc. Aliajele pot fi împiedicate să se sfărâme prin modificarea lor cu magneziu, alierea lor cu aditivi de elemente care rafinează grăuntele (V, Ti, Zg etc.) sau îl fac mai ductil. Rafinarea grăunților reduce concentrația impurităților și a compușilor acestora la granițele grăunților și afectează proprietățile aliajelor în același mod ca și scăderea generală a concentrației de impurități (P, Al, Ca) din aliaj, contribuind la scindare. Proprietățile termodinamice ale aliajelor Fe-Si (căldura de amestec, activitatea, solubilitatea carbonului) au fost studiate în detaliu și pot fi găsite în lucrări. Informații privind solubilitatea carbonului în aliajele Fe-Si sunt prezentate în figura 2, iar privind activitatea siliciului — în tabelul 1.
Proprietățile fizico-chimice ale compușilor de oxigen ai siliciului au fost studiate de P.V. Geld și colaboratorii săi. În ciuda importanței sistemului Si-O, diagrama acestuia nu a fost încă construită. În prezent, sunt cunoscuți doi compuși ai oxigenului din siliciu — siliciu SiO2 și monoxidul SiO. Există, de asemenea, indicii în literatura de specialitate cu privire la existența altor compuși de oxigen ai siliciului — Si2O3 și Si3O4dar nu există informații cu privire la proprietățile lor chimice și fizice.
În natură, siliciul este reprezentat doar de siliciu SiO2. Acest compus al siliciului este caracterizat prin:
1) duritate ridicată (scara Mohs 7) și refractabilitate (Tпл = 1996 К);
2) punct de fierbere ridicat (TPUNCT DE EBUVIERE = 3532 К). Presiunea de vapori a silicei poate fi descrisă prin ecuații (Pa):

3) formarea unui număr mare de modificări:

Particularitatea transformărilor alotropice ale SiO2 este că acestea sunt însoțite de modificări semnificative ale densității și volumului substanței, care pot provoca fisurarea și zdrobirea rocii;
4) tendința ridicată la supraîncălzire. Prin urmare, există posibilitatea de a fixa structura atât a topiturii lichide (sticlă), cât și a modificărilor la temperaturi ridicate ale cristobalitei și tridimitei ca urmare a răcirii rapide. Dimpotrivă, încălzirea rapidă poate topi cuarțul, ocolind structurile tridimitei și cristobalitei. Punctul de topire al SiO2 în acest caz scade cu aproximativ 100 ° C;
5) rezistență electrică ridicată. De exemplu, la 293 K aceasta este de 1 — 10 12 Ohm*m. Cu toate acestea, odată cu creșterea temperaturii, rezistența electrică a SiO2 scade, iar în stare lichidă siliciul nu este un conductor rău;
6) vâscozitate ridicată. Astfel, la 2073 K vâscozitatea este egală cu 1 — 10 4 Pa — s, iar la 2273 K — 280 Pa-s.
Acesta din urmă, potrivit lui N.V. Solomin, se explică prin faptul că SiO2ca și polimerii organici, este capabil să formeze lanțuri, care la 2073 K constau din 700 și la 2273 K — din 590 de molecule de SiO.2;
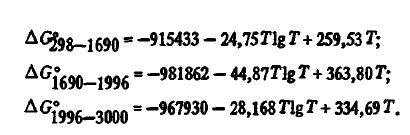
7) stabilitate termică ridicată. Energia Gibbs de formare a SiO2 din elemente, luând în considerare starea lor de agregare, în conformitate cu datele [3], este descrisă cu mare precizie prin ecuații:
Aceste date, după cum se poate observa din tabelul 2, diferă ușor de cele ale autorilor. Pentru calcule termodinamice se pot utiliza, de asemenea, ecuații cu doi termeni:
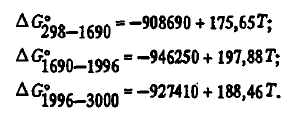
Monoxidul de siliciu SiO a fost descoperit în 1895 de Potter în faza gazoasă a cuptoarelor electrice. În prezent, s-a stabilit în mod fiabil că SiO există și în faze condensate. Conform studiilor lui P.V. Geld, oxidul se caracterizează prin densitate scăzută (2,15 g/cm 3 ), rezistență electrică ridicată (10 5-10 6 Ohm*m). Oxidul condensat este fragil, duritatea sa pe scara Mohs este ∼ 5. Temperatura de topire din cauza volatilității sale ridicate nu a putut fi determinată experimental. Potrivit lui O. Kubashevsky, aceasta este egală cu 1875 K, conform lui Berezhny, — 1883 K. Căldura de fuziune a SiO este de câteva ori mai mare decât ΔH 0 SiO2este raportată la 50242 J/mol. Se pare că, din cauza volatilității, acesta este supraestimat. Are o fractură vitroasă, culoarea sa se schimbă de la alb la ciocolată, ceea ce se datorează probabil oxidării sale de către oxigenul din aer. Fractura proaspătă a SiO are, de obicei, o culoare asemănătoare mazărelor, cu un luciu gras. Oxidul este stabil din punct de vedere termodinamic numai la temperaturi ridicate, deoarece SiO(Г). La răcire, oxidul se disproporționează prin reacție
Punctul de fierbere al SiO poate fi estimat aproximativ din ecuație:

Oxidul de siliciu gazos este termodinamic foarte stabil. Energia Gibbs de formare a acestuia poate fi descrisă prin ecuațiile (a se vedea tabelul 2):
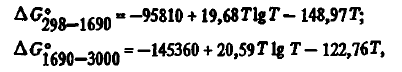
din care se poate observa că rezistența chimică a SiO, ca și a CO, crește odată cu creșterea temperaturii, ceea ce îl face un excelent agent de reducere pentru multe substanțe.
Ecuațiile cu doi termeni pot fi utilizate și pentru analize termodinamice:
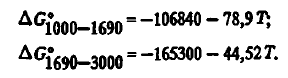
Compoziția gazelor de deasupra SiO2 a fost estimată de I.S. Kulikov. În funcție de temperatură, conținutul de SiO deasupra SiO2 este descris de ecuații:

Carbura de siliciu, ca și SiO, este unul dintre compușii intermediari formați în timpul reducerii SiO2. Carbura se caracterizează printr-un punct de topire ridicat.
În funcție de presiune, acesta este stabil până la 3033-3103 K (figura 3). La temperaturi ridicate, carbura de siliciu se sublimează. Cu toate acestea, presiunea de vapori a Si(Г) , Si2C(Г)SiC2(Г) peste carbură la T< 2800К невелико, что следует из уравнения

Carbura există în două variante — β-SiC cubic de temperatură joasă și α-SiC hexagonal de temperatură înaltă. Numai β-SiC se găsește în mod obișnuit în cuptoarele pentru feroaliaje. După cum reiese din calculele efectuate pe baza datelor, energia Gibbs de formare este descrisă de ecuațiile
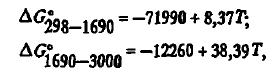
, care diferă semnificativ de date. Din aceste ecuații rezultă că carbura este stabilă termic până la 3194 K. În ceea ce privește proprietățile fizice, carbura se caracterizează prin duritate ridicată (~ 10), rezistență electrică ridicată (la 1273 K p≈0,13 ⋅ 10 4 μOm ⋅ m), densitate crescută (3,22 g/cm 3 ) și rezistență ridicată atât în atmosfere reducătoare, cât și oxidante.
Carbura pură este incoloră la aspect și are proprietăți semiconductoare, care se mențin la temperaturi ridicate. Carbura de siliciu tehnică conține impurități și, prin urmare, este de culoare verde sau neagră. Astfel, carbura verde conține 0,5-1,3 % impurități (0,1-0,3 % C, 0,2-1,2 % Si + SiO2 , 0,05-0,20 % Fe2O3, 0,01-0,08 % Al2O3 etc.). În carbura neagră conținutul de impurități este mai mare (1-2 %).
Carbonul este utilizat ca agent de reducere în producția de aliaje de siliciu. De asemenea, este principala substanță din care se fabrică electrozii și căptușelile cuptoarelor electrice de topire a siliciului și a aliajelor sale. Carbonul este destul de răspândit în natură, conținutul său în scoarța terestră fiind de 0,14 %. În natură se găsește atât în stare liberă, cât și sub formă de compuși organici și anorganici (în principal carbonați).
Carbonul (grafitul) are o rețea cubică hexagonală. Densitatea cu raze X a grafitului este de 2,666 g/cm 3 , iar densitatea picnometrică este de 2,253 g/cm 3 . Se caracterizează prin temperaturi ridicate de topire (~ 4000 °C) și de fierbere (~ 4200 °С), rezistență electrică crescând cu temperatura (la 873 K p≈9,6 μOm⋅m, la 2273 K p≈15,0 μOm⋅m), destul de puternică. Rezistența sa în timp la mustăți poate fi de 480-500 MPa. Cu toate acestea, grafitul electrodului are σв = 3,4÷17,2 MPa. Duritatea grafitului pe scara Mohs este după cum urmează ~ 1.
Carbonul este un excelent agent de reducere. Acest lucru se datorează faptului că rezistența unuia dintre compușii săi de oxigen (CO) crește odată cu creșterea temperaturii. Acest lucru se poate observa din energia Gibbs de formare a acestuia, care, conform calculelor noastre bazate pe date, este bine descrisă atât de ecuația trinomială
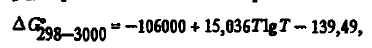
și ecuațiile cu doi termeni:
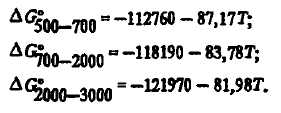
Dioxid de carbon CO2este termodinamic robust doar până la 1300 K. Energia Gibbs a CO2 este descris de ecuații: