Deoxidarea carbonului în vid. Scăderea presiunii în sistem afectează semnificativ dezvoltarea proceselor care au loc odată cu formarea fazei gazoase, în special procesul de oxidare a carbonului. Oxidarea carbonului în vid are loc ca urmare a interacțiunii sale cu oxigenul dizolvat în oțel:
După cum se poate observa din ecuație, în condiții de echilibru în oxidarea carbonului, conținutul de oxigen din metal este proporțional cu presiunea parțială a CO. Formarea bulelor de CO în procesul de oxidare a carbonului este posibilă numai atunci când presiunea de formare a acestora (pсо în ecuație) atinge presiunea externă asupra bulei Ppuz. formată din presiunea atmosferică Rat, și presiunea ferrostatică Pf2 , precum și presiunea de tensiune superficială egală cu 2σ/r ( unde σ este tensiunea superficială, r este raza bulei).
Din ecuația (Ppuz. = Рат + Рф+ 2σ/r) rezultă că, odată cu scăderea presiunii atmosferice, adică crearea vidului, presiunea asupra bulei scade și, în mod corespunzător, presiunea parțială a CO scade. Proporțional cu aceasta, conform ecuației 2, conținutul de oxigen în echilibru cu carbonul scade. Astfel, la scăderea presiunii în sistem, afinitatea chimică a carbonului față de oxigen crește. Prin urmare, în vid reacția de oxidare a carbonului este mai dezvoltată — are loc dezoxidarea oțelului cu carbon. La presiune scăzută, carbonul devine un puternic agent de deoxidare. De exemplu, în condiții de echilibru, deja la o presiune a sistemului de 10 kPa, carbonul este un deoxidant mai puternic decât siliciul, iar la o presiune de 0,1 kPa, care este obișnuită pentru tratamentul în afara cuptorului în vid, este de asemenea mai puternic decât aluminiul. (Fig)
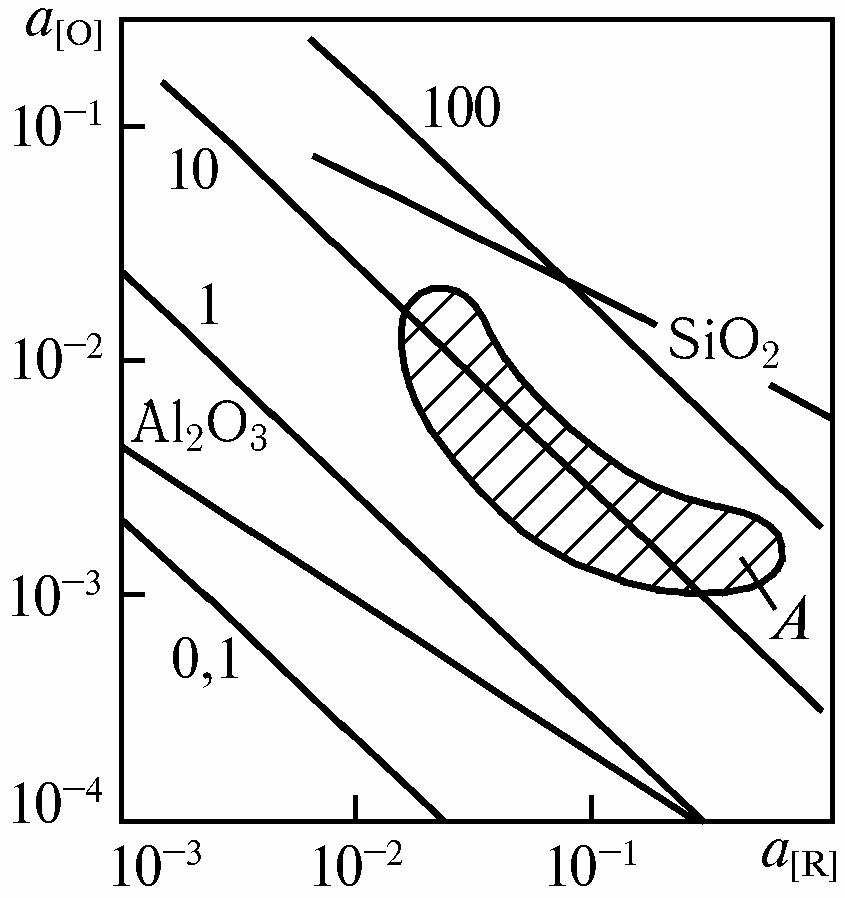
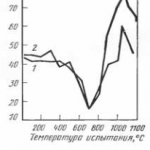
Fig. Dependența activității oxigenului a[O] în oțel în funcție de activitatea agentului deoxidant a[R] la 1873 K. Cifrele la liniile drepte — PСО, kPa; A — suprafața a[O]obținută la vacuumarea oțelului
Cu toate acestea, în condițiile reale de tratare a oțelului în afara cuptorului, o astfel de scădere proporțională regulată a conținutului de oxigen din metal și, în consecință, a valorii produsului [C]*[O]=m este observată numai atunci când presiunea este redusă la 10kPa în condițiile de tratare în vid a oțelului carbon lichid (figura A) și până la 1kPa în cazul tratării în vid a oțelului inoxidabil lichid. Reducerea suplimentară a presiunii nu determină o scădere corespunzătoare a valorii produsului [C]*[O]=m, iar capacitatea de deoxidare a carbonului practic nu crește. Creșterea capacității de deoxidare a carbonului în timpul tratării în vid a oțelului lichid cu reducerea presiunii numai până la anumite valori se explică prin particularitățile procesului de deoxidare prin carbon.
La nuclearea într-un lichid omogen, o bulă de gaz, datorită razei sale mici, se confruntă cu o presiune capilară uriașă (presiunea de tensiune superficială — σ/ r în ecuația (3)). Acest lucru conduce la faptul că reacția de oxidare a carbonului într-un mediu omogen nu se dezvoltă. Ea se desfășoară pe suprafețele interfaciale disponibile. Aici bula poate atinge o dimensiune critică atunci când presiunea exterioară formată din presiunea atmosferică, ferrostatică și capilară nu depășește presiunea de eliberare a CO ca urmare a reacției chimice. Dar, de asemenea, pe suprafața interfacială la nuclearea unei bule de CO acționează o presiune capilară considerabilă, care duce la o anumită suprasaturare a metalului cu carbon și oxigen în comparație cu concentrațiile de echilibru. Odată cu scăderea presiunii atmosferice și a presiunii ferrostatice asupra bulei, rolul presiunii capilare crește, iar la o valoare suficient de mică a primelor două sumande ale presiunii totale asupra bulei, presiunea capilară are o importanță decisivă în dezvoltarea reacției de oxidare a carbonului. Prin urmare, o scădere suplimentară a presiunii atmosferice nu afectează semnificativ concentrațiile de carbon și oxigen din metal.
Rolul presiunii capilare este evidențiat de exemplul dat anterior: presiunea limită până la care se observă influența sa asupra capacității de deoxidare a carbonului este egală cu aproximativ 10 kPa pentru fier, iar pentru oțelul inoxidabil, care are o tensiune superficială mult mai scăzută, această dependență se menține până la 1 kPa. În legătură cu cele de mai sus, în cazul în care tratamentul topiturii prin vid este destinat să utilizeze în principal avantajele dezoxidării carbonului, nu este necesar să se creeze un vid profund în unitate. Va fi suficient să se reducă presiunea de la 100 la 0,1-0,2 kPa, ceea ce, de obicei, este ușor de realizat cu cele mai simple pompe. Reducerea presiunii sub 0,1 kPa necesită costuri semnificative, iar efectul său asupra condițiilor de dezoxidare a carbonului se apropie asimptotic de zero.
Cu toate acestea, chiar și la gradul de oxidare prin carbon în vid (fig.), care poate fi obținut în condiții industriale, acesta se dovedește a fi un antioxidant mai puternic decât siliciul la un conținut mai mare de aproximativ 0,1 % și este comparabil cu efectul deoxidant al aluminiului la conținutul obișnuit al acestui element în oțel de până la 0,01 %.
Pentru a crește capacitatea de deoxidare a carbonului în vid, este posibil să se faciliteze condițiile de eliberare a carbonului prin introducerea de bule de gaz gata în metal, de exemplu prin suflare cu gaz neutru. Conform datelor experimentale, purjarea metalului cu argon permite reducerea semnificativă a presiunii la care se observă efectul acestuia asupra gradului de deoxidare, adică creșterea capacității de deoxidare a carbonului. Astfel, în condiții identice, conținutul de oxigen din metal după vacuumarea în stare de liniște a corespuns presiunii de echilibru a CO de 16 kPa, după vacuumarea cu agitare — 4,5 kPa, iar după vacuumarea cu purjare cu argon — 3 kPa.
Din cauza dificultății de nucleare a bulelor de CO, oxidarea carbonului are loc pe suprafețele interfaciale. Prin urmare, rata de decarburare în timpul vacuumării este limitată de transferul de masă la această suprafață. După cum au arătat studiile, la un conținut scăzut de carbon (mai mic de ∼0,1 %), rata de oxidare a acestuia este limitată de transferul de masă al carbonului, iar la un conținut mai ridicat de carbon — de transferul de masă al oxigenului. În consecință, în conformitate cu prima lege a lui Fick, rata procesului la un conținut de carbon mai mic și mai mare de ∼0,1 % este determinată, respectiv, de ecuațiile
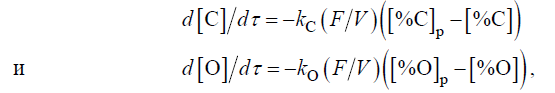
unde τ este timpul, s; k C și kО— sunt coeficienții de transfer de masă ai carbonului și respectiv oxigenului, m/s; p este indicele care indică starea de echilibru; FV este raportul suprafață/volum, m-1 .
După cum se poate observa din aceste ecuații , rata de oxidare a carbonului crește odată cu creșterea suprafeței relative de contact dintre metal și faza gazoasă și a coeficientului de transfer de masă, care crește odată cu creșterea intensității de agitare.
Deoxidarea carbonului în vid afectează și alte procese de rafinare a oțelului. Barbotarea metalului de către bulele de CO favorizează degazarea oțelului și flotarea incluziunilor nemetalice, adică rafinarea din oxigen, hidrogen, azot și incluziuni nemetalice
Procese de degazare. Dintre elementele care sunt în stare gazoasă în condiții normale la temperatura camerei, oxigenul, hidrogenul și azotul sunt dizolvate în oțelurile lichide. Eliminarea directă a oxigenului din metal în timpul tratamentului în vid este practic imposibilă, deoarece presiunea parțială a oxigenului, care se află în echilibru cu soluția saturată de oxigen chiar și în fierul pur, la 1600 °C este de aproximativ 0,6 mPa, ceea ce, luând în considerare conținutul de oxigen în aer de 21 %, corespunde unei presiuni totale de 2,9 mPa. Îndepărtarea oxigenului din oțelul lichid care conține elemente care scad coeficientul de activitate a oxigenului este posibilă la presiuni mai mici, dar în practica tratării oțelului în afara cuptorului prin vid, nu se utilizează astfel de presiuni mici. Eliminarea gazelor dizolvate în oțel în timpul tratării în vid se datorează unei scăderi a presiunii lor parțiale în atmosferă, odată cu scăderea presiunii totale deasupra metalului.
Conform legii lui Sieverts, solubilitatea hidrogenului și a azotului în fierul lichid este proporțională cu rădăcina pătrată a presiunii lor parțiale:
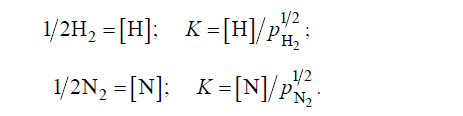
Cu toate acestea, este necesar să se ia în considerare faptul că această relație este observată numai atunci când gazul biatomic este în soluție sub formă de particule simple — atomi sau ioni. În prezența unor legături chimice între particulele de gaz dizolvat și componentele topiturii se observă abateri de la legea lui Siverts. Prin urmare, relațiile descrise de această lege, în practica siderurgică sunt valabile numai pentru hidrogen, iar pentru azot, care poate interacționa cu componentele topiturii, se observă adesea abateri notabile de la legea lui Siewerts. În plus, o serie de elemente (Cr, V, Al), care în oțelul lichid nu leagă azotul în nitruri, reduc coeficientul de activitate al azotului, reducând posibilitatea eliminării acestuia.
Îndepărtarea hidrogenului și azotului dizolvate în metal este posibilă prin trei mecanisme: 1) formarea de bule de gaz în metal și plutirea lor; 2) îndepărtarea (desorbția) de la interfața metal-atmosferă; 3) formarea de bule pe suprafața solidă interfacială și plutirea lor. După cum s-a arătat atunci când s-a luat în considerare reacția de oxidare a carbonului, nuclearea omogenă a bulelor de CO este imposibilă din cauza presiunii capilare mari. Și mai puțin probabilă este posibilitatea formării de bule de hidrogen sau azot în metalul lichid, a cărui concentrație este foarte mică. După cum se va arăta, este de obicei insuficient să se depășească chiar și o presiune ferrostatică la adâncimea de câțiva centimetri. Prin urmare, primul dintre mecanismele menționate nu este realizat.
Procesul de desorbție a hidrogenului și azotului din oțelul lichid poate fi vizualizat ca constând din trei etape:
1. Transferul hidrogenului și azotului dizolvate în metal din volum la interfața cu faza gazoasă.
2. adsorbția atomilor de hidrogen și azot în stratul superficial al metalului lichid: [H] = Hfloat;
3. Molizarea atomilor adsorbiți în molecule și transferul lor în faza gazoasă: 2Hfloat=H2;
Ratele primei și celei de-a doua etape sunt descrise de ecuația de ordinul întâi:
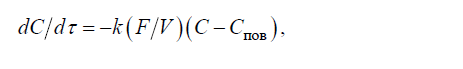
(8)
unde(C-Cfloat) — gradientul de concentrație al concentrației de echilibru a substanței dizolvate la un moment dat; k — constanta de viteză; F și V — suprafața și respectiv volumul metalului.
Rata celei de-a treia etape este descrisă de o ecuație de ordinul al doilea:
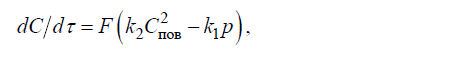
unde k1 și k2 sunt constantele de viteză ale reacțiilor directe și inverse; p este presiunea parțială a gazului deasupra topiturii.
Atunci când această etapă este cea mai lentă, C=Cpov, deoarece concentrațiile de gaz din volum și de la suprafață au timp să se egalizeze. S-a stabilit experimental că rata de eliminare a gazului din metal este descrisă de o ecuație de ordinul întâi. În consecință, etapa limită a procesului considerat este prima sau a doua etapă. Pe baza legilor cineticii formale, este dificil să se separe influența proceselor de adsorbție și difuzie. Chiar și influența elementelor tensioactive (O, S) asupra procesului de degazare, adesea utilizată pentru a evalua etapa de adsorbție, nu este un argument convingător în favoarea acestei etape. La urma urmei, îngroșarea suprafeței acestor elemente determină o scădere a suprafeței active a topiturii, care, conform ecuației (9), duce la o încetinire a transferului de substanțe. Prin urmare, în conformitate cu rezultatele datelor experimentale, se presupune că procesul de degazare a metalului lichid este limitat de etapa de difuzie-adsorbție, a cărei rată este descrisă de ecuația cinetică (8). Integrarea acestei ecuații conduce la ecuația
C = Cp + (Co — Cp)exp(-kF/V)τ, (10)
unde C0 este concentrația inițială (la τ=0)
După cum se poate observa din ecuația (10), timpul τ de degazare a oțelului la o concentrație dată de impuritate cu concentrații inițiale și de echilibru date scade cu creșterea constantei de viteză k și a suprafeței relative F/V. Constanta de viteză poate fi crescută prin creșterea intensității de agitare, iar suprafața relativă poate fi crescută prin reducerea volumului de metal.
Formarea bulelor pe suprafața interfacială solidă (al treilea mecanism) are loc în prezența porilor pe aceasta, a căror dimensiune trebuie să fie suficient de mare pentru a forma o bulă cu o rază nu mai mică decât cea critică, adică capabilă de creștere spontană și, în același timp, suficient de mică pentru a nu fi umplută cu metal lichid. Prima dintre aceste condiții a fost luată în considerare în studiul reacției de oxidare a carbonului, iar cea de-a doua este determinată de unghiul de umectare a suprafeței solide cu metalul lichid. Condițiile de formare a bulelor de gaz pe suprafața solidă sunt reprezentate grafic în fig. Acestea sunt posibile în zona din stânga liniilor continue 1-4, care definesc condiția de nucleare a bulelor, respectiv H2 sau CO, nu mai mică decât raza critică a liniilor punctate 5, 6, care definesc posibilitatea apariției porilor, care nu sunt umpluți cu metal lichid.
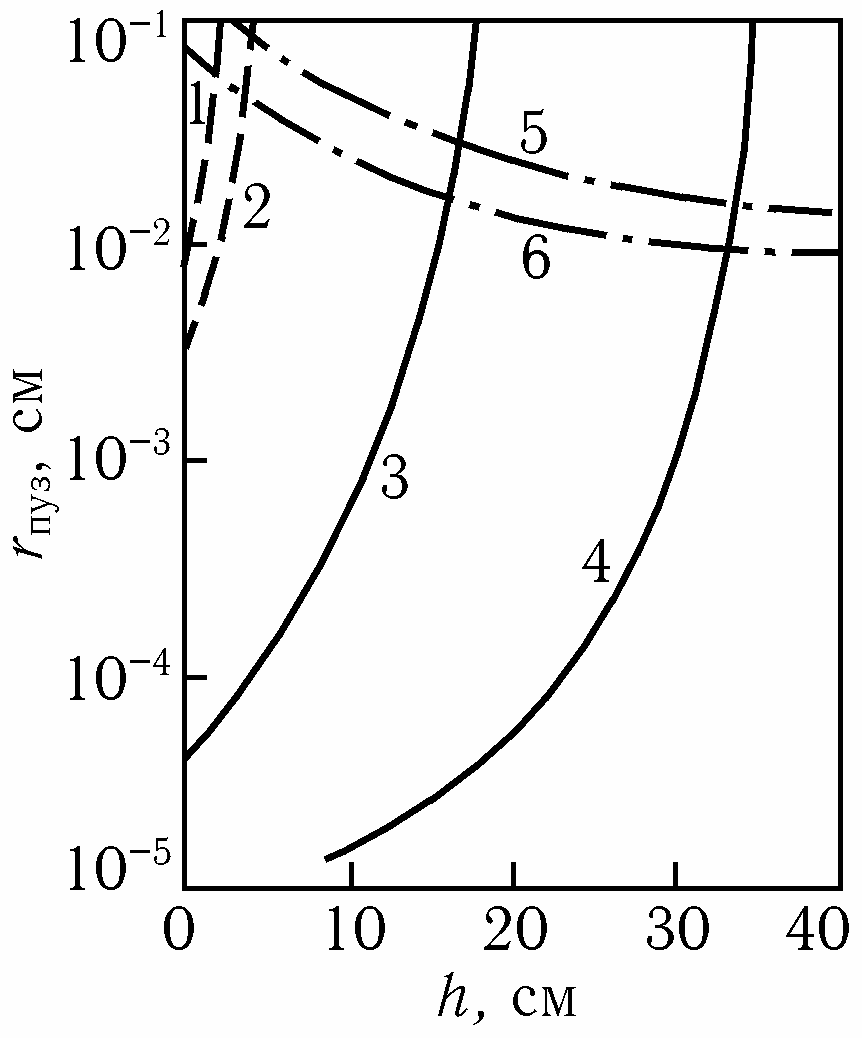
Fig. Dependența razei porilor la formarea bulelor în zidăria refractară de adâncimea băii și de conținutul de hidrogen de echilibru în metal, %: 4-1 0-3 (1), 5-1 0-4 (2), sau pСО(3 — 13 kPa, 4 — 26 kPa). Unghi de umezire, deg: 10 (5), 60 (6)
După cum se poate observa în figură, formarea bulelor de hidrogen (curbele 1, 2 și 5, 6) pe o suprafață solidă devine imposibilă deja la o adâncime de câțiva centimetri. Bulele de CO pot fi formate la o adâncime de zeci de centimetri (curbele 3, 4 și 5, 6).
Creșterea intensității agitației metalice favorizează livrarea reactivilor către pori și desprinderea bulelor de pe suprafața solidă, ceea ce accelerează procesul. Același lucru se întâmplă și în cazul creșterii suprafeței relative de contact a fazelor lichidă și solidă, precum și a rugozității acesteia din urmă.
Pe lângă cele trei mecanisme de degazare enumerate, mai este posibil un altul — transferul de gaze din soluție (hidrogen, azot) sau datorită reacției chimice (CO) în bule de gaz gata formate. Acest mecanism este realizat în mare măsură atunci când oțelul lichid este purjat cu argon.