Primele experimente de obținere a manganului prin electroliză în străinătate au fost efectuate de R. Bunsen în 1854. În Rusia, celebrul electrochimist P. P. Fedotiev a investigat procesul de extracție a manganului prin electroliză din soluții de clorură și sulfură de mangan. În URSS, prima instalație industrială de producere a manganului prin electroliză a fost construită în Transcaucazia în 1942, pe baza lucrărilor experimentale efectuate sub îndrumarea academicianului Academiei de Științe a URSS R. I. Agladze, iar în prezent manganul metalic prin electroliză din soluții de sulfură de mangan este produs la ZZF. În Regatul Unit, dezvoltarea electrolizei soluțiilor de mangan, chimiei manganului și termochimiei aluminiului a început în 1940.
La scară mică (~Cererea în continuă creștere de mangan electrolitic pentru topirea oțelurilor de mai multe tipuri, precum și a aliajelor de metale feroase și neferoase a determinat o dezvoltare rapidă a producției sale în anii ’50-’70. La începutul anilor ’80, producția de mangan electrolitic se ridica la 80 de mii de tone pe an. ~80 de mii de tone pe an.
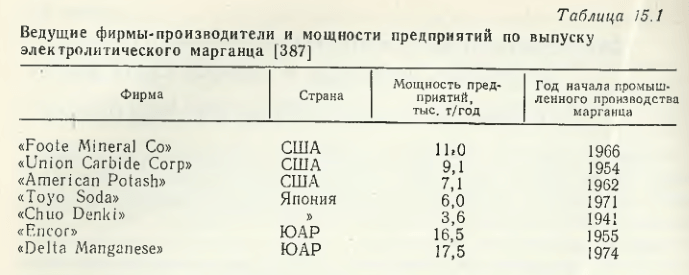
În străinătate, bazele procedeului electrolitic al manganului au fost dezvoltate de „US Bureau of Mines” (SUA) în 1935. Începutul producției industriale de către „Electro Manganese Compr” pe baza acestor dezvoltări datează din 1939. Astfel, dezvoltarea bazelor teoretice și tehnologice ale procedeului de extracție electrolitică a manganului din soluții (topituri saline), precum și dezvoltarea industrială a producției sale în URSS și în străinătate, au mers în paralel în anii 30-40. Dezvoltările științifice pentru îmbunătățirea tehnologiei de extracție a manganului și creșterea calității acestuia continuă să fie realizate intens în prezent. Cei mai mari producători de mangan electrolitic și volumele de producție ale acestuia sunt prezentate în tabelul 15.1.
Schema tehnologică de producție a manganului electrolitic la întreprinderile enumerate în tabelul 15.1 include patru etape principale:
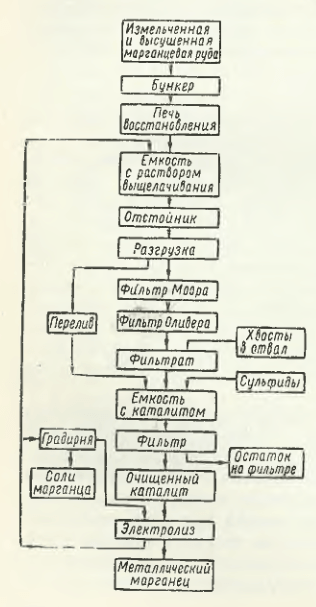
- Pregătirea termică a minereului de mangan (concentrat) pentru levigare prin măcinarea acestuia și prăjirea ulterioară prin reducere, pentru a transforma compușii superiori de oxigen ai manganului în compuși inferiori; oxizii de fier sunt transformați în Fe3O4care, spre deosebire de FeO, este mai puțin solubil în H diluat2SO4;
- levigarea minereului de mangan recopt (concentrat) în electrolizorul uzat cu respectarea regimurilor care asigură un transfer minim de fier în soluție;
- purificarea soluției înainte de electroliză de fier și metale neferoase (Ni, Co etc.) prin precipitarea compușilor acestor metale prin adăugarea de sulfat de amoniu (NH4)2SO4;
- electroliza la 38 °C și o densitate de curent de 4,3-5,4 A/dm 2 timp de ∼32 h. Ca exemplu, figura 15.1 prezintă schema tehnologică de producere a manganului electrolitic conform R. Durrer și G. Volkert.
Manganul electrolitic produs în străinătate este împărțit în diferite calități în funcție de destinația sa. Manganul este produs sub formă de fulgi (1,7-2 mm) cu un conținut scăzut de hidrogen și oxigen (2 .. Alături de manganul sub formă de fulgi, manganul electrolitic este produs sub formă de granule mai mici de 6-8 ochiuri și
Echivalenți electrochimici și potențiale standard de electrod ale manganului
Echivalenții electrochimici ai manganului q [r/(A — h)] sunt următorii: Mn 2+ + 2e → Mn, qMn 3+ = 1,0245; Mn 4+ + 4e → Mn, qMn 4+ = 0,5122; Mn 5+ + 5e → Mn, qMn 5+ = 0,509; Mn 7+ + 7e → Mn, qMn 7+ = 0,273.
Razele cristalochimice ale cationilor de mangan scad cu creșterea gradului de oxidare și au următoarele valori: rMn 2+ = 0,091 nm; rMn 4+ = 0,052 nm; rMn 6+ = 0,030 nm. Pentru comparație, observăm că rFe 2+ = 0,083 nm; rCO 2+ = 0,072 nm și rNi 2+ = 0,078 nm. Raza cristalochimică a anionilor rSO 4- 4 = 0,295 nm; rCO 2- 3 = 0,265 nm; rPO 4- 4 = 0,030 nm; rSiO 4- 4 = 0,290 nm. Baymakov Yu. V. și A. I. Zhurin pentru următoarele nouă reacții reductiv-oxidative reversibile dau următoarele valori ale potențialelor standard (φ0, В):
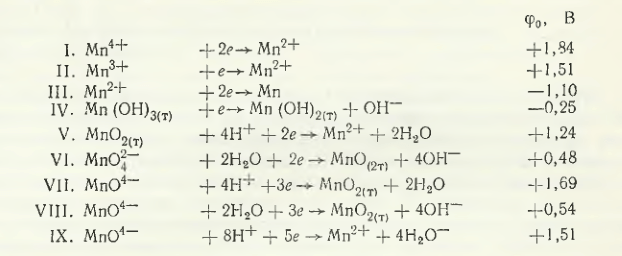
Din aceste date rezultă că pe catod se creează în primul rând condițiile pentru reducerea cationilor de mangan de valență superioară la valență inferioară și, în final, pentru precipitarea manganului (reacțiile I-III). În medii alcaline cu utilizarea anodului insolubil pe acesta este posibilă în primul rând reacția IV (φ0 = -0,25 V), iar în soluții neutre și acide — reacția V (φ0= 124 В). Reacțiile V, VII și VIII sunt însoțite de consum de ioni H + , iar reacțiile IV, VI și VIII — de ioni OH — . Potrivit lui Yu. V. Baymakov și A. I. Zhurin, în prezența ionilor cu valențe superioare în soluții neutre, la catod se formează inevitabil săruri bazice. Din acest motiv, la electroliza soluției de mangan (pH ≥ 7), ionii de valență superioară nu trebuie lăsați în spațiul catodic. Ionii Mn 2+ se descarcă, așa cum rezultă din reacțiile de mai sus, la un potențial electronegativ (φ0 = -1,10 V) și numai din soluții cu concentrație scăzută de ioni de hidrogen (pH ≥ 7,0). În același timp, ionii de mangan și hidrogen sunt reduși simultan la catod și se observă o supratensiune mare de hidrogen la catod, conform lui Y. V. Baymakov și A. I. Zhurin. În acest sens, sărurile de amoniu influențează procesul de descărcare a manganului. Datorită formării unei săruri duble (NH4)2Mn(SO4)2 valoarea pH-ului de formare a Mn(OH)2 este deplasată la 9. Aceasta reduce concentrația de ioni de hidrogen și deplasează potențialul de descărcare al ionilor săi către partea electronegativă.
Autorii explică influența impurităților din electrolit (Fe, Ni, Co, Cu etc.) prin faptul că supratensiunea hidrogenului asupra lor este nesemnificativă, astfel încât chiar și cantități mici ale acestora în soluție (electrolit) cresc viteza de descărcare a ionilor de hidrogen, care este însoțită de pătrunderea acestor săruri în manganul catodic și o scădere a randamentului curentului. De exemplu, conținutul de 0,005 g Co/l și 0,004 g As/l reduce randamentul curentului cu 20%. Dacă în soluție sunt prezenți ioni Fe 3+, este posibilă reacția de oxidare a manganului precipitat: 2Fe 3+ + Mn → Mn 2+ + 2Fe 2+ , iar prezența ionului H + creează condiții pentru reacția Mn + 2H + → Mn 2+ + H2.