Condițiile de desfășurare a proceselor chimice care duc la modificarea compoziției fazelor care interacționează — metal, zgură și gaz — într-un convertor cu oxigen se caracterizează printr-o presiune inițială ridicată a suflului [până la 1,013-1,217 MN/m 2 (10-12 at)], un potențial de oxidare ridicat al acestuia, prezența unei zone de reacție limitate cu temperaturi ridicate la limitele de contact dintre fluxul de oxidare și topitură și un amestec puternic dezvoltat de metal și zgură datorită energiei cinetice a suflului și a produselor gazoase ale decarburării în baie.
Potențialul oxidant ridicat al fazei gazoase creează condiții pentru dezvoltarea simultană a reacțiilor de oxidare a elementelor metalului topit — siliciu, mangan și carbon.
Rapoartele dintre vitezele proceselor de formare a zgurii, reacțiile de la interfața zgură-metal și reacțiile din volumul metalic sunt strâns legate de intensitatea și organizarea fluxului de oxidant.
Controlul modului de suflare a topiturii BOF prin modificarea înălțimii tuyerei de oxigen și a consumului minim de oxigen, precum și utilizarea tuyerei cu duze de design diferit reprezintă un mijloc puternic de reglare a proceselor de oxidare în fazele de interacțiune.
Afinitatea chimică caracterizează capacitatea substanțelor de a interacționa chimic. Dacă există mai multe substanțe în sistem, atunci, în primul rând, acele substanțe care au cea mai mare afinitate chimică între ele intră într-o reacție chimică. Cu cât afinitatea chimică este mai mare, cu atât mai puternic este compusul chimic rezultat. În topirea convertorului, datele privind afinitatea chimică a elementelor pentru oxigen sunt de o importanță capitală.
Măsura afinității chimice a două elemente care intră într-o interacțiune chimică (reacție) este modificarea energiei Gibbs ∆G o în timpul acestei reacții (fosta denumire a energiei Gibbs este energie liberă, adică este acea parte a energiei eliberate în timpul reacției care este eliberată și poate fi transformată în lucru).
Energiile Gibbs ∆G o ale reacțiilor de oxidare ale diferitelor elemente la diferite temperaturi sunt prezentate în Fig. 1. Afinitatea chimică a unui element față de oxigen este cu atât mai mare cu cât valoarea negativă a ∆G o este mai mare în valoare absolută, adică cu cât curba de variație a ∆G o a unei anumite reacții de oxidare se află mai jos în Fig. 1.
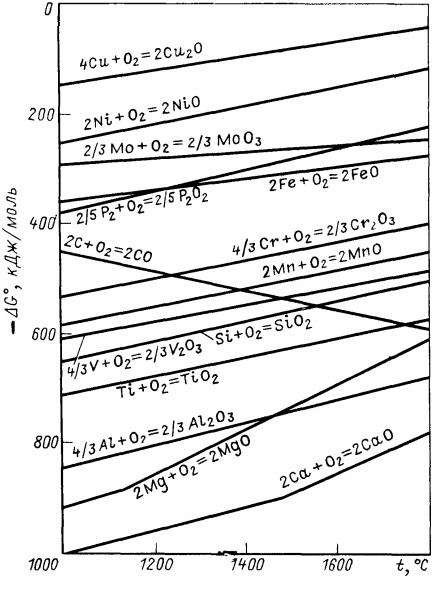
Figura 1: Afinitatea chimică a elementelor față de oxigen la diferite temperaturi
Din datele din figura 1 rezultă că afinitatea chimică a nichelului, cuprului și molibdenului față de oxigen este sensibil mai mică decât cea a fierului, astfel încât aceste elemente nu sunt oxidate în prezența fierului lichid (în timpul purjării cu oxigen în convertor). Afinitatea chimică față de oxigen a calciului, aluminiului și magneziului este foarte mare, astfel încât, dacă acestea ar fi introduse în baia convertorului, ar fi oxidate în câteva secunde.
Componentele comune ale băii lichide a convertorului: siliciul, manganul și carbonul au o afinitate chimică mai mare față de oxigen decât fierul, astfel încât aceste elemente sunt oxidate în timpul suflării, nu fierul.
La temperaturi scăzute (1450-1500°C și mai puțin), siliciul și manganul au o afinitate chimică mai mare pentru oxigen, iar la temperaturi mai ridicate, o afinitate chimică mai mică pentru oxigen decât carbonul. Din acest motiv, siliciul și manganul sunt întotdeauna oxidate la începutul suflării, când temperatura din convertor este relativ scăzută.
Uneori, afinitatea chimică a elementelor față de oxigen este estimată prin presiunea de disociere a oxidului; cu cât presiunea de disociere este mai mică, cu atât oxidul este mai puternic și afinitatea chimică a constituenților oxidului este mai mare.
Principiul deplasării echilibrului (principiul Le Chatelier) constă în faptul că echilibrul stabilit al unui proces chimic se deplasează dacă se modifică condițiile externe. Utilizarea acestui principiu face posibilă schimbarea cursului reacțiilor în direcția dorită. Acest principiu poate fi formulat după cum urmează: dacă se exercită o influență externă asupra unui sistem în echilibru, echilibrul din acesta se deplasează în direcția care reduce influența exercitată. Astfel, dacă temperatura este crescută, reacția se va deplasa în direcția însoțită de absorbția de căldură și viceversa. Dacă în sistem se adaugă componente din partea stângă a ecuației reacției (de exemplu, componentele A și B în reacția: A+B = C + D), echilibrul reacției se va deplasa spre dreapta (în direcția scăderii cantităților de substanțe A și B) și invers.
O modificare a presiunii afectează reacțiile care implică faza gazoasă. Dacă, de exemplu, presiunea crește, reacția va merge în direcția scăderii numărului de moli de substanțe gazoase (deoarece presiunea din sistem este mai mică cu cât sunt mai puține molecule de gaz în el).
Cunoașterea principiului lui Le Chatelier facilitează controlul proceselor de topire BOF.
De exemplu, este ușor să se decidă ce zgură ar trebui să fie, astfel încât reacția de desulfurare să fie mai completă: [S] + F e + (CaO) = (CaS) + (FeO). Conform principiului lui Le Chatelier, reacția va merge spre dreapta dacă vom crește concentrația componentelor din partea stângă a ecuației și vom scădea concentrația componentelor din partea dreaptă. În consecință, pentru o desulfurare mai completă (reacție spre dreapta), zgura trebuie să conțină o cantitate mare de CaO și o cantitate mică de FeO.
Conținut
Principalele reacții ale proceselor de conversie
Fig. 2 arată modificarea compoziției metalului și a fazei de zgură, precum și a temperaturii băii în cursul procesului de convertire cu oxigen. Procesul se caracterizează prin absența perioadelor bine definite de oxidare a elementelor separate (siliciu și mangan, carbon, fosfor) tipice pentru suflarea de fund cu suflare cu aer. Aceasta ar trebui să fie asociată cu un exces semnificativ de oxigen în zona de reacție limitată și cu prezența unor zone cu temperaturi ridicate ale metalelor. O condiție suplimentară este reactivitatea ridicată a zgurii care conține oxizi de fier și calciu.
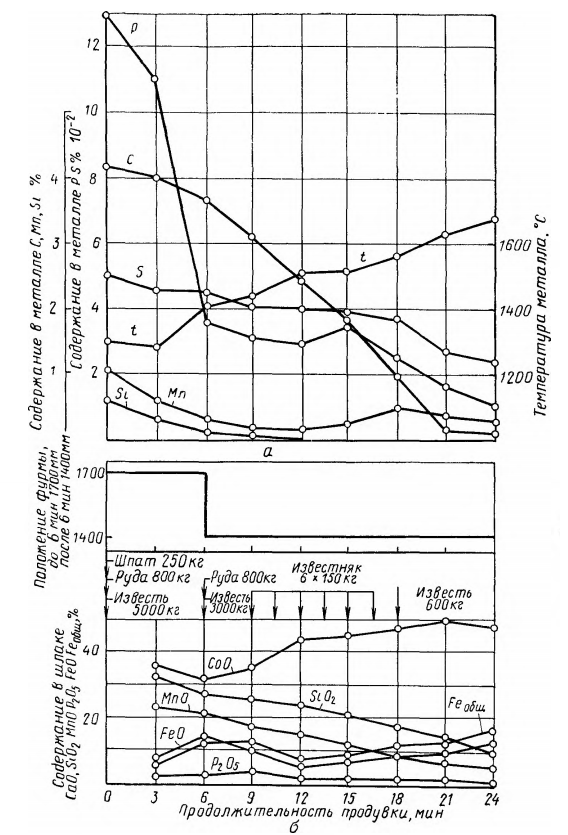
Fig. 2. Modificarea compoziției și temperaturii metalelor (a) și a compoziției zgurii (b) în cursul procesului de conversie a oxigenului într-un convertor de 100 tone
Oxidarea siliciului
Oxidarea siliciului se realizează în primele 3-5 minute ale procesului, în funcție de concentrația acestuia în fonta prelucrată.
Reacțiile care reflectă acest proces sunt: [Si] + O2 = (SiO2) și [Si] + (FeO) = (SiO2) + [Fe], arată posibilitatea reacției directe a siliciului cu agentul oxidant gazos sau cu oxidul de fier format din zgură.
Simultan cu oxidarea siliciului, manganul este, de asemenea, oxidat prin reacții similare, dar acest proces în condițiile convertorului de oxigen se desfășoară cu mai puțină completitudine. Tranziția manganului în zgură este, de obicei, limitată la un conținut rezidual în metal de 0,2-0,4%, care, în cursul suflării ulterioare, poate crește suplimentar datorită reducerii manganului din zgură prin reacțiile: (MpO) + [Fe ] = [Mp] + (FeO), (MpO) + [C] = [Mp] + CO.
Dezvoltarea notabilă a reducerii manganului este asociată cu starea de temperatură ridicată a zgurii cu conținut ridicat de bază, cu creșterea activității oxidului de mangan din aceasta și cu reducerea conținutului și a activității FeO în condițiile decarburării intensive a metalului. La un conținut de mangan în fonta brută de 1,0-1,5%, conținutul său final în oțel este, de obicei, de 0,3-0,6%, ceea ce permite economisirea ferromanganezului la aducerea compoziției metalului la un anumit grad.
Oxidarea carbonului.
Oxidarea carbonului. Oxidarea excesului de carbon este una dintre sarcinile principale ale topiturii convertorului, deoarece fonta conține între 2,8 și 4,6% C, în timp ce oțelul topit conține mult mai puțin.
Carbonul la temperaturile de producere a oțelului este oxidat în principal în CO (mai puțin de 10% din carbon este oxidat în CO2 mai puțin de 10 % din carbon este oxidat). Oxidarea carbonului dizolvat în metal poate avea loc prin următoarele reacții:
[C]+ 1/2 O2 = CO+ 152470 J/mol;
[C] + [O] = CO + 22370 J/mol;
[C] + (FeO) =CO + Fe-98840 J/mol.
A treia reacție este însoțită de absorbție de căldură, după cum indică semnul minus.
Oxidarea carbonului este însoțită de formarea fazei gazoase — bule de CO. Solubilitatea CO în fier este neglijabilă, astfel încât, în timpul oxidării carbonului, bulele de CO sunt eliberate din baie, provocând efectul de fierbere a băii, agitarea acesteia și formarea de spumă.
Reacția de oxidare a carbonului este ireversibilă, deoarece produsul de reacție CO este eliminat din baie. Viteza reacției de oxidare a carbonului este determinată de viteza de alimentare cu oxidant (oxigen) și de condițiile de formare și eliberare a produsului gazos de reacție CO.
În orice punct al băii convertorului se poate forma o bulă de CO dacă presiunea din aceasta (Pso) depășește următoarea valoare:
Рso ≥ Ratm + Rmet + Rshl + P p.n.
Adică, depășește presiunea totală creată de:
- presiunea atmosferică Ratm ;
- presiunea straturilor suprapuse de metal lichid și zgură Rmet și Rshl;
- presiunea creată în interiorul bulei ca urmare a efectului „compresiv” al tensiunii superficiale a metalului P p.n .
Luând în considerare aceste valori, s-a stabilit că formarea bulelor de CO în interiorul metalului lichid este imposibilă, adică reacția de oxidare a carbonului poate avea loc la suprafața interfeței metalului cu faza gazoasă existentă (jeturi de oxigen suflate, bule de CO care plutesc din baie). În comparație cu alte unități siderurgice, convertoarele de oxigen creează condiții favorabile pentru oxidarea carbonului (există în permanență cavități de gaz în volumul metalului ca urmare a introducerii jeturilor de oxigen în baie).
Reacția de oxidare a carbonului ocupă un loc special printre celelalte reacții, deoarece atunci când este emis gazul CO, acesta asigură agitarea băii; egalizarea compoziției și a temperaturii; îndepărtarea hidrogenului și a azotului gazos nociv din metal; accelerarea tuturor reacțiilor dintre metal și zgură, deoarece suprafața de contact metal-scură crește în timpul agitării.
Suflare până la obținerea unui conținut scăzut de carbon în metal
Purjarea până la un conținut scăzut de carbon în metal prezintă anumite dificultăți. Purjarea de sus permite obținerea fără dificultăți a unui conținut de carbon în metal de 0,05-0,06%; la suflarea ulterioară a oxigenului pentru o oxidare mai completă a carbonului crește în mod esențial oxidarea fierului, ai cărui oxizi trec în zgură, adică crește puternic pierderile de fier cu zgura (sub formă de FeO și Fe2O3).
La suflarea inferioară și combinată se creează condiții mai favorabile pentru oxidarea completă și rapidă a carbonului și, fără o supraoxidare puternică a zgurii și a metalului, este posibil să se obțină un conținut de carbon în metal de 0,02-0,03 % și mai mic. Motivele pentru aceasta sunt următoarele:
- datorită intensității mai mari a amestecului de metal și zgură, are loc o oxidare suplimentară a carbonului prin reacția: [C] + (FeO) = CO + Fe;
- datorită gazelor suplimentare (neutre sau naturale) insuflate prin partea inferioară, volumul cavităților de gaz din baie crește; acest lucru facilitează formarea CO, adică reacția de decarburare;
- gazele insuflate suplimentar, care se amestecă cu CO, produsul reacției de decarburare, scad presiunea parțială a CO în zona de reacție; prin urmare, în conformitate cu principiul Le Chatelier, echilibrul reacției se deplasează spre dreapta, către o oxidare mai completă a carbonului.
În plus, după terminarea purjării cu oxigen, se efectuează adesea o purjare prin agitare de jos cu argon; în acest caz continuă și oxidarea carbonului cu oxigen.
FeO conținut în zgură, care vă permite să obțineți în conținutul de metal al carbonului
Cea mai importantă caracteristică a procesului de conversie a oxigenului este oxidarea rapidă a fosforului.
Defosforizare.
Îndepărtarea fosforului din metal în zgură are loc în două etape, dintre care prima este formarea oxidului de P2О5 :
Oxidul format P2О5 este un compus fragil (punct de fierbere 590 ° C), astfel încât poate fi reținut în zgură numai sub formă de compuși mai puternici cu alte componente ale zgurii. Astfel de compuși sunt ZSaOr2О5 sau 4CaOr2O5 a căror formare reprezintă a doua etapă a procesului de defosforizare:
Dacă aceste două reacții sunt însumate, se obține reacția totală de eliminare a fosforului:
Reacția poate avea loc numai până la starea de echilibru determinată de temperatură și de compoziția zgurii.
Reacția poate continua numai până la starea de echilibru determinată de temperatură și de compoziția zgurii. Odată atins echilibrul, nu va exista nicio eliminare a fosforului în zgură. Completitudinea reacției este adesea caracterizată de coeficientul de distribuție a fosforului între zgură și metal (P2О5)/[Р].
O eliminare mai completă a fosforului din zgură (deplasarea echilibrului reacției spre dreapta) contribuie la o creștere a bazicității zgurii CaO / SiO2 (sau conținutul de CaO), creșterea oxidării zgurii (sau conținutul de FeO) și o temperatură relativ scăzută.
În același timp, gradul de eliminare a fosforului obținut în timpul topirii depinde de viteza reacției de defosforizare, care depinde de suprafața de contact metal-scură și de vâscozitatea zgurii. Deoarece reacția are loc la limita dintre metal și zgură, curgerea mai rapidă a acesteia este favorizată de o creștere a suprafeței de contact metal-scură, adică de o mai bună amestecare a metalului cu zgura. Accelerarea reacției este favorizată și de reducerea vâscozității zgurii, deoarece în zgura vâscoasă este dificilă difuzarea componentelor implicate în reacție.
Vâscozitatea zgurii scade odată cu creșterea cantității de componente lichefiante (CaF2, FeO etc.) și cu creșterea temperaturii.
Având în vedere cele de mai sus, trebuie remarcat faptul că efectul temperaturii asupra defosforării este dublu; odată cu scăderea temperaturii, echilibrul reacției de defosforare se deplasează către o eliminare mai completă a fosforului, dar viteza de defosforare scade din cauza creșterii vâscozității zgurii.
De mare importanță este și cantitatea de zgură, deoarece, la același coeficient de distribuție, cantitatea de fosfor transferată în zgură este cu atât mai mare cu cât masa de zgură este mai mare.
La convertoarele cu suflare superioară, reacția de defosforizare nu atinge starea de echilibru; într-o măsură mai mare, ea se apropie de echilibru la suflarea inferioară și combinată, unde intensitatea amestecului de metal cu zgură este mult mai mare.
Valoarea coeficientului de distribuție a fosforului (P2О5)/[P] la suflarea superioară a fontei obișnuite (0,2-0,3% P și mai puțin) variază de la 50 la 100-120 (grad de defosforizare > 9 0 % ). La suflarea superioară a fontelor cu fosfor, coeficientul de distribuție a fosforului ajunge la 200 și uneori la 500, la suflarea inferioară și combinată — mai mare și la sfârșitul suflării poate ajunge la 700.
Desulfurarea.
În topirea BOF, precum și în alte procese de producție a oțelului, sulful este eliminat din metal în zgura principală prin reacție: [S] + Fe + (CaO) = (CaS) + (FeO), al cărei efect termic este foarte mic.
Această reacție, ca și reacția de eliminare a fosforului, poate ajunge la o anumită stare de echilibru, după care eliminarea sulfului din metal nu va mai avea loc. Completitudinea reacției este adesea caracterizată de coeficientul de distribuție a sulfului între zgură și metal (S )/[S ].
Eliminarea mai completă a sulfului (deplasarea echilibrului de reacție spre dreapta) este favorizată de bazicitatea ridicată a zgurii și de conținutul scăzut de FeO din aceasta. Deoarece efectul termic al reacției este aproape de zero, o modificare a temperaturii nu determină practic o deplasare a echilibrului acesteia.
Completitudinea desulfurării, precum și a defosforizării depinde de viteza de reacție și crește odată cu creșterea suprafeței de contact metal-scură (îmbunătățirea amestecului acestora) și scăderea vâscozității zgurii. Creșterea temperaturii favorizează eliminarea sulfului, deoarece desulfurarea are loc la o rată mai mare datorită scăderii vâscozității zgurii. Creșterea cantității de zgură asigură, de asemenea, un conținut mai scăzut de sulf în metal.
Deoarece zgura BOF conține o cantitate mare de FeO, condițiile pentru reacția de desulfurare în convertorul cu oxigen sunt nefavorabile și desulfurarea este limitată. La suflarea superioară, coeficientul de distribuție (S)/[S] este de 2-12; gradul de desulfurare (ponderea sulfului eliminat, % din conținutul inițial) nu depășește 30-40%.
Gazele reziduale constau practic din monoxid de carbon și dioxid de carbon.
Prezența CO2 indică utilizarea incompletă a oxigenului pentru reacțiile de oxidare cu metalul topit, ceea ce este evident mai ales la începutul procesului în modul de jet nedepus. Datele corespunzătoare sunt prezentate în Fig. 3. Din acestea se poate observa că conținutul de CO2 în această perioadă poate ajunge la 20%, ceea ce indică o subutilizare a oxidantului pentru decarburare. Cu toate acestea, în zona jetului, precum și în timpul reacției sale cu metalul, după cum arată datele experimentale și calculele, conținutul de CO2 ar trebui să fie mai mare. Împreună cu oxigenul liber, dioxidul de carbon este consumat în principal pentru reacțiile oxidative cu topitura: CO2 + [C] = 2CO; CO2 + [Fe] = (FeO) + CO.
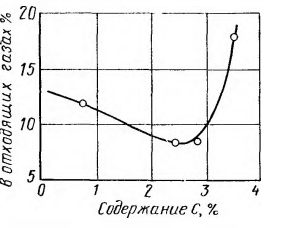
Figura 3 — Variația CO2 în gazele reziduale în cursul topirii cu convertor de oxigen.
Deoxidarea oțelului.
La sfârșitul epurării, metalul din convertor conține 0,03-0,08 % oxigen dizolvat, în fierul solid la temperatura camerei solubilitatea oxigenului (cantitatea care poate fi menținută în soluție) nu depășește 0,003 %. Dacă acest exces de oxigen nu este eliminat, el va fi eliberat în timpul procesului de solidificare și din metalul solidificat, cauzând numeroase defecte. Printre acestea se numără: roșeața, cauzată de eliberarea peliculelor de oxid pe granițele grăunților în timpul cristalizării; bulele, inversate ca urmare a interacțiunii oxigenului dizolvat cu carbonul; îmbătrânirea oțelului; un număr mare de incluziuni nemetalice de oxid, cauzând o scădere a rezistenței la impact și a unei serii de alte proprietăți mecanice ale oțelului; reducerea ductilității oțelului etc.
Pentru a preveni apariția acestor defecte, oțelul se dezoxidează. În funcție de gradul de dezoxidare, oțelul este împărțit în calm (complet dezoxidat), clocotitor și semiliniștit.
Deoxidarea oțelului liniștit.
Scopul dezoxidării oțelului liniștit este de a minimiza cantitatea de oxigen dizolvată în oțelul lichid și de a o elimina din metalul lichid cât mai complet posibil. Oțelul de conversie este dezoxidat prin metoda precipitării: în metal se introduc dezoxidanți — elemente cu o afinitate chimică mai mare pentru oxigen decât fierul. Acestea interacționează cu oxigenul dizolvat pentru a forma oxizi, care sunt insolubili în oțelul lichid și sunt eliberați în volumul metalului ca particule mici ale unei faze independente.
Oțelul stabil se dezoxidează cu mangan, siliciu, aluminiu și, în unele cazuri, calciu, metale de pământuri rare (REM) etc. Dezoxidarea are loc în următoarele reacții. Deoxidarea are loc prin următoarele reacții:
Produsele de oxidare (oxizii) trebuie îndepărtate de metal. Deoarece oxizii sunt mai ușori decât metalul, ei plutesc, ceea ce asigură îndepărtarea unei părți din produsele de dezoxidare; îndepărtarea lor este îmbunătățită prin agitarea metalului, de exemplu, prin suflarea cu argon, în cazan, a materialelor pulverulente. Oxizii mici rămași constituie cea mai mare parte a incluziunilor nemetalice de oxid găsite în oțelul solidificat; aceștia deteriorează calitatea oțelului.
Elementele dezoxidante au o capacitate inegală de dezoxidare; cu cât este mai mare afinitatea chimică a elementului față de oxigen, cu atât este mai mare capacitatea sa de dezoxidare, adică cu atât va rămâne mai puțin oxigen dizolvat în metalul lichid după adăugarea acestui agent de dezoxidare. Pe măsură ce capacitatea de dezoxidare crește, elementele dezoxidante sunt dispuse în următoarea ordine: mangan, siliciu, aluminiu, titan, calciu, REM. De obicei, se observă următoarea ordine a deoxidării — mai întâi se introduce un deoxidant slab (manganul), apoi unul mai puternic (siliciul, apoi aluminiul). Manganul și siliciul sunt introduse sub formă de feroaliaje, iar aluminiul sub formă pură.
Deoxidarea oțelurilor în fierbere și semiîn fierbere.
Scopul dezoxidării oțelurilor în fierbere și semiîn fierbere este de a reduce conținutul de oxigen dizolvat la un nivel care să asigure intensitatea necesară de fierbere a metalului în căptușeală. Oțelul în fierbere se dezoxidează numai cu un deoxidant slab — manganul; oțelul semiîn fierbere — cu mangan și o cantitate mică de siliciu.
Zgură siderurgică.
Convertirea, ca toate procesele siderurgice, este însoțită de formarea de zgură. Scoria este un aliaj de oxizi cu o cantitate mică de CaS, MnS și uneori CaF2.
Zgură se formează din produsele de oxidare ale componentelor metalice lichide (SiO2, MnO, FeO, Fe2O3 , Р2О5); căptușeala de dizolvare; fluxurile adăugate (var, fluorină, bauxită etc.); rugina deșeurilor de oțel și, uneori, alte impurități (nisip, argilă); zgura de amestecător, care ajunge în convertor la turnarea fontei brute. La baza zgurii stau oxizii; în funcție de proprietățile lor chimice, oxizii sunt împărțiți în trei grupe:
Oxizii bazici și acizi posedă: afinitate chimică ridicată între ei.
Cei amfoterici se comportă în mediu bazic ca cei acizi, iar în mediu acid ca cei bazici.
Ca urmare a interacțiunii chimice a oxizilor din zgură se formează un număr mare de compuși diferiți (2Ca0*SiO2; 2FeO — SiO2CaO — Fe2О3; MnO — SiO2 și multe altele), unele dintre acestea fiind disociate.
Astfel, zgurile sunt formate atât din oxizi liberi, cât și din cei legați în diferiți compuși chimici.
Se face o distincție între zgurii bazice și zgurii acide. Zgurăturile bazice sunt zgurături dominate de oxizi bazici (în principal CaO); zgurăturile acide sunt zgurături dominate de oxizi acizi (de obicei S iO2). Scoriile de conversie sunt bazice; principalii lor constituenți sunt CaO (43-53%), SiO2 (14-22%), MnO (până la 12%).
Zgură trebuie să aibă anumite proprietăți fizice și chimice, următoarele proprietăți ale zgurii de bază au cea mai mare influență asupra tehnologiei de topire.
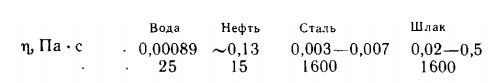
- Basicitatea — raportul (CaO)/( SiO2); în zgurii cu conținut crescut de P2О5 bazicitatea este exprimată prin raportul (CaO)/(SiO2) + (P2О5). Zgură cu bazicitate < 1,5 называют низкоосновными, с основностью в пределах 1,6—2,5 — среднеосновными, с основностью от 2,5 до 3,5—3,8 — высокоосновными. Конвертерные шлаки должны иметь основность 2,8—3,5, чтобы обеспечивалось удаление из металла в шлак фосфора и серы. При основности >3,5, adică la un conținut ridicat de CaO poate începe solidificarea zgurii.
- Capacitatea de oxidare — capacitatea de a oxida impuritățile metalului lichid. Această proprietate a zgurii este determinată în primul rând de oxidarea acesteia, adică de conținutul în zgură de FeO și Fe2О3 (de obicei, conținutul de Fe2О3 în zgura de conversie este de trei până la patru ori mai mic decât conținutul de FeO). Oxidarea zgurii este estimată prin conținutul de FeO din aceasta, %; suma conținutului de FeO + Fe2О3 (%); conținutul de fier din zgură și, uneori, alte caracteristici.
- Vâscozitatea depinde de temperatură și de compoziția zgurii și variază foarte mult: de la 0,02 la 0,2-0,5 Pa-s. Pentru comparație, mai jos sunt prezentate valorile vâscozității unui număr de lichide la diferite temperaturi t: La o vâscozitate prea mare (zgură groasă) încetinește eliminarea fosforului și a sulfului din zgură și alte procese de schimb între metal și zgură; la o vâscozitate scăzută (zgură lichidă) în zgură se dizolvă rapid căptușeala. Vâscozitatea zgurii bazice crește odată cu creșterea conținutului său de CaO, MgO, Cg2О 3și scade odată cu creșterea CaF2, А12О3Si02Fe2О3. Pentru a reduce vâscozitatea (lichefierea), în zgură se introduc substanțe care conțin CaF , A1 , Si0 , Fe2, А12О3Fe2О 3Na2O, etc.