În cea mai generală formulare, combustia este o reacție fizico-chimică rapidă cu eliberare de căldură și lumină. În natură și în tehnologie, cele mai frecvent observate procese de ardere sunt cele asociate cu oxidarea substanțelor combustibile de către oxigenul din aer. Cu toate acestea, multe substanțe intră în reacții de ardere între ele și în absența oxigenului. Astfel, hidrogenul și unele metale ard în clor gazos, cuprul — în vapori de sulf, aluminiul în brom etc.
Pe lângă reacțiile de ardere care apar ca urmare a combinării chimice a diferitelor substanțe, există reacții de ardere asociate cu descompunerea gazelor, lichidelor și solidelor (acetilenă, nitroglicerină, nitroceluloză, azidă de plumb etc.).
Un tip de combustie este explozia și detonarea, atunci când reacția de combinare sau descompunere a substanțelor are loc cu o viteză de sute și chiar mii de metri pe secundă.
Se face o distincție între substanțele combustibile solide, lichide și gazoase (vapori). Substanțele solide și lichide pot fi suspendate în aer (sub formă de praf sau ceață).
Combustia este posibilă numai în anumite condiții: prezența unei substanțe combustibile și a unei substanțe care favorizează procesul de combustie și o încălzire suficientă. Combustia poate continua numai dacă cantitatea de căldură eliberată în timpul arderii depășește transferul de căldură către mediu. Combustia include, de asemenea, explozia și detonarea.
Produsele de ardere în cazul arderii complete a substanțelor sunt gazele incombustibile și apa. În cazul combustiei incomplete, produsele combustiei conțin monoxid de carbon și alți compuși combustibili.
Trebuie remarcat faptul că accidentele grave de incendiu se produc adesea din cauza excesului de fum și de monoxid de carbon în zona incendiului.
În timpul procesului de ardere, se degajă o cantitate mare de căldură, care este determinată de căldura de ardere a substanțelor combustibile. Eliberarea de căldură în mediul înconjurător în timpul unui incendiu se face prin convecție și, în principal, prin radiație. Temperatura de ardere depinde în principal de căldura de ardere a substanțelor combustibile și de cantitatea de produse de ardere formate.
Substanțele combustibile pot fi aprinse prin contact direct cu corpuri puternic încălzite sau flăcări deschise, prin încălzire prin radiații și prin reacții exotermice în substanța combustibilă.
Procesul de ardere oxidativă include fazele de preîncălzire, oxidare, autoaprindere și ardere ulterioară. Figura 1 prezintă curba de variație a temperaturii procesului de ardere în timp. La încălzirea unei substanțe combustibile cu o temperatură inițială tн până la temperatura de debut a oxidării tо are loc o creștere lentă a temperaturii, deoarece căldura furnizată din exterior este consumată prin topirea, vaporizarea sau descompunerea substanțelor combustibile. După ce substanța combustibilă este încălzită la tо temperatura de ardere crește mai rapid în timp datorită eliberării de căldură din reacția de oxidare.
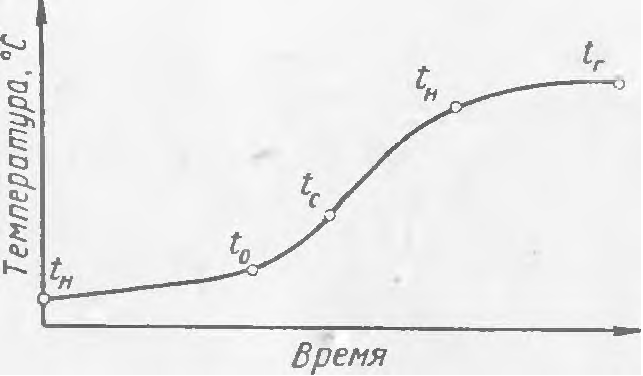
Cu toate acestea, temperatura tо este încă insuficientă pentru continuarea autoaprinderii, deoarece transferul de căldură către mediu depășește generarea de căldură din reacția de oxidare inițiată. Atunci când temperatura de autoaprindere tc există un echilibru între aportul de căldură la substanța combustibilă și transferul de căldură către mediu. Acest lucru duce la o nouă creștere rapidă a temperaturii. La temperatura tп apare flacăra și începe un proces de ardere stabil tг.
Curba temperatură-timp pentru un incendiu este prezentată în figura 2.
Combustia este un proces fizico-chimic foarte complex. Conform conceptelor moderne, în procesul de ardere se formează intermediari puțin stabili, dar foarte activi sub formă de atomi liberi, peroxizi, radicali. Reactivitatea oxigenului crește semnificativ atunci când este încălzit.
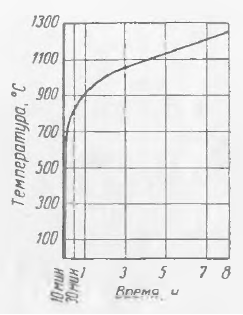
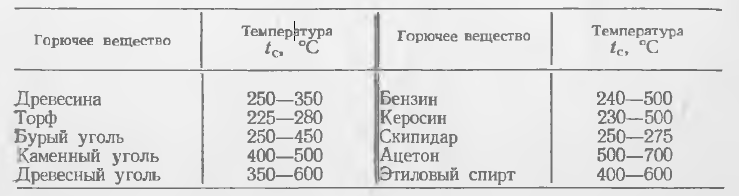
Temperatura de autoaprindere a substanțelor combustibile variază foarte mult nu numai pentru substanțe diferite, ci și pentru aceeași substanță. Această temperatură depinde de mulți factori variabili: concentrația amestecului, presiunea, volumul recipientului (pentru amestecurile de gaze-vapori și praf-aer), măcinat™ (pentru combustibilii solizi). Tabelul 1 prezintă limitele de variație ale temperaturii de autoaprindere a unor combustibili.
Exploziile amestecurilor de gaze, vapori și pulberi combustibile cu aer pot avea loc numai dacă constituenții lor combustibili sunt amestecați în prealabil cu oxigenul din aer. Pentru diferite gaze, vapori și pulberi există anumite limite de concentrație explozivă, care sunt limitele inferioară și superioară ale amestecului exploziv. Atunci când conținutul de componente combustibile din amestec este mai mic decât limita inferioară, amestecul nu explodează și nu arde, iar atunci când conținutul de substanțe combustibile este mai mare decât limita superioară, amestecul nu explodează, dar arde și prezintă, prin urmare, un risc de incendiu.
Cu cât limita inferioară a concentrației explozive este mai mică, cu atât substanța combustibilă este mai periculoasă. Pericolul de explozie al amestecurilor este determinat și de intervalul dintre limita inferioară și cea superioară a amestecului. Cu cât intervalul este mai mare, cu atât amestecul exploziv este mai periculos. De exemplu, acetilena (C2Н2) limita inferioară de explozie a unui amestec cu aer (în procente volumice) este de 2,6 %, iar limita superioară este de 82 %. Pentru metan (CH4), aceste valori sunt de 5,3 % și, respectiv, 14 %. Prin urmare, pericolul de explozie al acetilenei este mult mai mare decât cel al metanului.
Temperatura la explozie a amestecurilor de gaze și vapori fluctuează într-un interval larg și este de 1500-3000 °C, iar presiunea dezvoltată la explozie nu depășește de obicei 1,1 mn/m 2 (11 atm). Cu toate acestea, atunci când conținutul de oxigen din amestec crește și când amestecul este comprimat în timpul exploziei (de exemplu, în conductele de gaz de mare lungime), presiunea de explozie poate crește foarte mult și poate ajunge chiar la detonare atunci când viteza de propagare a flăcării atinge 1000-4000 m/sec și presiunea este de 8 MN/m 2 (80 atm) sau mai mult.
Conținut
Pericolul de incendiu al combustibililor solizi
Pericolul de incendiu al substanțelor solide este determinat de compoziția lor și depinde în mare măsură de suprafața specifică a acestor substanțe. De exemplu, hârtia în rulouri arde foarte lent, în timp ce arderea hârtiei desfășurate este foarte rapidă. Atunci când conținutul de umiditate al solidelor crește, inflamabilitatea și viteza de ardere a acestora scade semnificativ. Viteza de ardere a solidelor depinde, de asemenea, de cantitatea de produse volatile eliberate prin descompunerea substanțelor în timpul arderii; pe măsură ce constituenții volatili cresc, viteza de ardere crește.
În arderea solidelor, se observă procese de ardere cu flacără și fără flacără. În arderea fără flacără, oxidarea substanței combustibile are loc în stratul superficial. Unul dintre principalele gaze combustibile în stingerea substanțelor care conțin carbon este monoxidul de carbon.
Metalele alcaline încep să ardă după ce sunt topite (unele dintre ele formează flăcări atunci când interacționează cu apa). Arderea aluminiului, magneziului și calciului este însoțită de formarea unei cantități semnificative de fum alb format din oxizi ai acestor metale. Procesul de ardere a metalelor alcaline este intensificat semnificativ de măcinarea acestora. Astfel, așchiile de magneziu și de aliaje de magneziu (de exemplu, electron) ard foarte intens. Praful din aceste metale în stare de aerogel (sub formă de depuneri) arde lent, însă, fiind adus în stare de suspensie, explodează.
Arderea lemnului este un proces complex. Când temperatura lemnului crește la 110-130 °C, apa este eliberată și apoi începe descompunerea lemnului. Produsele de descompunere între 130-200 °C constau în vapori de apă și dioxid de carbon. Pe măsură ce temperatura crește în continuare, în compoziția gazelor eliberate apar monoxidul de carbon, hidrogenul, metanul și alte gaze combustibile. La 230-250 °C, produsele de descompunere a lemnului sunt aprinse de o sursă externă de căldură, după care lemnul continuă să ardă. La 300 °C cantitatea maximă de gaze combustibile este eliberată de lemn.
Faza de ardere cu flacără a lemnului scade treptat pe măsură ce se formează un strat de cărbune pe suprafața acestuia și începe faza de ardere fără flacără a acestui cărbune. După arderea stratului de cărbune, gazele combustibile sunt din nou emise intensiv și apare o flacără. Apoi se formează un nou strat de cărbune și începe faza de ardere fără flacără etc.
La sfârșitul unei serii de cicluri de ardere cu flacără și fără flacără, atunci când tot lemnul s-a descompus, reziduurile de cărbune ard fără emisie de flacără. Trebuie remarcat faptul că, odată cu încălzirea prelungită a lemnului în acesta din urmă, există procese de descompunere și oxidare, care pot reduce temperatura de aprindere a lemnului la 110-130 ° C.
Pericolul de incendiu al combustibililor lichizi
Pericolul de incendiu al lichidelor inflamabile este determinat de punctul de aprindere al vaporilor lichidului care se vaporizează la (introducerea unei surse de căldură. Punctul de aprindere este cea mai scăzută temperatură la care vaporii unei substanțe combustibile creează un amestec aer-vapori deasupra suprafeței sale care se aprinde atunci când este introdusă o sursă de căldură (de exemplu, flacără deschisă).
În timpul flashover-ului, suprafața lichidului inflamabil nu se încălzește la o temperatură suficientă pentru a vaporiza lichidul în mod energic, iar combustia ulterioară încetează. Dacă temperatura lichidului în momentul flăcării este suficientă pentru ca combustia să urmeze flăcării, această temperatură se numește temperatura de aprindere a lichidului inflamabil.
Cu cât punctul de aprindere al unui lichid inflamabil este mai scăzut, cu atât pericolul de incendiu este mai mare Conform clasificării existente, toate lichidele inflamabile sunt împărțite în două clase. Clasa I include lichidele cu un punct de aprindere mai mic de 45°C (de exemplu, benzină, alcool, eter, parafină etc.), iar clasa II include lichidele cu un punct de aprindere mai mare de 45°C (de exemplu, uleiuri, păcură etc.). Lichidele inflamabile din clasa I sunt denumite lichide inflamabile, iar lichidele din clasa II sunt denumite lichide combustibile.
Trebuie remarcat faptul că pericolul de incendiu al unui anumit număr de solide (de exemplu, naftalina, fosforul, camforul etc., care se vaporizează la temperatura normală) este caracterizat și de punctul lor de aprindere.
Lichidele inflamabile au o diferență mică (1-2°C) între punctul de aprindere al vaporilor și temperatura de aprindere. În cazul lichidelor inflamabile, această diferență ajunge la 30 0 C sau mai mult.
Pericolul de incendiu al lichidelor crește odată cu scăderea punctului de aprindere, a temperaturilor de aprindere și autoaprindere, precum și odată cu creșterea vitezei de vaporizare și scăderea limitei inferioare de concentrație a amestecului exploziv de vapori lichizi cu aer.
Pericolul de incendiu al prafului
Praful de substanțe combustibile în stare de aerogel (sub formă de depuneri de praf) poate fumega și arde, iar fiind sub formă de aerosol, adică fiind suspendat în aer, poate exploda, formând amestecuri explozive praf-aer. Arderea prafului este favorizată în mare măsură de adsorbția oxigenului din aer de către praf. Explozivitatea prafului crește odată cu reducerea particulelor de praf datorită creșterii suprafeței sale specifice. Temperatura de autoaprindere a prafului combustibil variază de obicei între 700-900 °C, dar unele tipuri de praf au o temperatură de autoaprindere relativ scăzută (de exemplu, negrul de fum explodează la 360 °C).
La fel ca gazele și vaporii combustibili, pulberile au limite de concentrație explozivă inferioară și superioară. Limita inferioară de concentrație explozivă (sursă de căldură — corp înroșit) pentru praful de sulf este 7, praful de zahăr 10,3, praful de aluminiu 7 și praful de cărbune 17,2 g/m 3 .
Limitele concentrației de praf exploziv depind de umiditate, dispersabilitate, temperatură și puterea sursei de căldură și de alți factori. Presiunea dezvoltată în exploziile de praf nu depășește de obicei 0,4-0,6 mn/m 2 (4-6 atm).
Arderea spontană
Unele substanțe au capacitatea de a adsorbi gaze și oxigen din aer, ceea ce crește rata reacțiilor de oxidare și crește temperatura acestor substanțe. În cazul în care se creează condiții în care aportul de căldură este mai mare decât emisia de căldură către mediu, aceste substanțe pot arde ca urmare a creșterii continue a temperaturii. Procesul în care combustia (substanțelor are loc ca urmare a autoîncălzirii se numește combustie spontană. Este clar că substanțele care încep procesul de combustie spontană la o temperatură scăzută prezintă un risc crescut de incendiu.
Substanțele capabile de ardere spontană sunt împărțite în mai multe grupe. Grupul I include substanțe de origine vegetală, de exemplu cereale umede, fân, rumeguș. Cauza creșterii temperaturii în cazul acestora sunt procesele biologice; creșterea ulterioară a temperaturii se datorează oxidării, care duce la combustia spontană a acestor substanțe.
Grupa II include cărbunele greu și brun (cu excepția cărbunelui slab) și turba. Procesele biologice care au loc în turbă contribuie la combustia spontană a acesteia. Turba se aprinde spontan la temperaturi relativ scăzute (120-140°C).
Grupa III include uleiurile și grăsimile, iar uleiurile de origine vegetală (ulei de in etc.) prezintă un risc sporit de incendiu, deoarece conțin compuși organici nesaturați care se pot oxida și polimeriza. Uleiurile animale și minerale prezintă un risc de incendiu mult mai scăzut.
Pericolul de combustie spontană crește brusc atunci când uleiurile ajung pe materialele de ștergere și pe hainele de lucru. Pelicula de ulei formată pe suprafața acestor materiale adsorbe oxigenul din aer, în urma căreia temperatura crește și materialele se pot aprinde. În practica uzinelor metalurgice sunt cunoscute cazuri de incendii datorate combustiei spontane a materialelor de ștergere și a îmbrăcămintei de lucru uleioase.
Grupa IV include substanțe chimice și anumiți compuși. Această grupă include substanțe capabile de ardere spontană în contact cu aerul, de exemplu hidrogen fosfat, hidrogen siliciu, fosfor alb, arsine, praf de aluminiu și zinc, cărbune proaspăt preparat și funingine, compuși organometalici. Sulfuri de fier FeS și Fe2S3au proprietăți piroforice. Atunci când aceste sulfuri intră în contact cu aerul, temperatura lor crește atât de mult încât constituie o sursă de aprindere a substanțelor combustibile.
O serie de substanțe se aprind în contact cu apa, de exemplu metalele alcaline, carburile de calciu și de metale alcaline etc. Aprinderea provine din faptul că interacțiunea acestor substanțe cu apa produce gaze combustibile, care se aprind datorită exotermicității reacțiilor. Uleiurile și grăsimile se aprind spontan în oxigen comprimat.