Procesul metalurgic este producția de metale, aliaje, compuși chimici ai metalelor, precum și produse intermediare care conțin metale.
Materiile prime inițiale pentru producerea majorității metalelor sunt minereurile, pentru prelucrarea cărora se dezvoltă o schemă tehnologică de prelucrare metalurgică, adică o secvență și condiții optime de procese, la care se obțin cei mai buni indicatori tehnici și economici în ceea ce privește costul și calitatea metalului.
Există sute de scheme tehnologice diferite pentru obținerea metalelor, dar esența fundamentală a tuturor schemelor este aceeași — separarea metalului din rocile reziduale și elementele asociate. Întregul complex de operațiuni incluse în schemele tehnologice, este oportun să se împartă în patru etape, fiecare dintre care rezolvă o anumită problemă:
- prima etapă — obținerea concentratului de minereu prin metode mecanice (concasare, măcinare, îmbogățire);
- a doua etapă — obținerea concentratului „chimic” (prăjire, sinterizare-decompoziție, dizolvare, precipitare, topire etc.)
- etapa a treia — obținerea metalului „brut” sau a compusului său chimic (clorinare, rectificare, extracție, distilare);
- a patra etapă — obținerea metalului pur (metode chimice și fizice de purificare).
Prima etapă a procesului implică separarea minereului mineral de steril prin metode de îmbogățire, în urma cărora minereul este împărțit în două părți: concentrat, în care este transferată cantitatea principală de minereu mineral, și reziduuri, formate în principal din steril.
A doua etapă a circuitului implică îndepărtarea rocilor reziduale rămase prin metode chimice și metalurgice. Această etapă are ca rezultat producerea fie a unui compus chimic al unui anumit metal, fie a unui aliaj metalic.
În etapa a treia, în unele sisteme se obține „metal brut (contaminat cu impurități), în altele — un compus chimic pur de metal, care este materialul de bază pentru obținerea metalului pur în ultima etapă.
În etapa a patra, metalul pur este obținut prin reducerea compusului chimic corespunzător sau prin purificarea metalului „brut”.
Obținerea metalelor este o sarcină dificilă și se complică semnificativ atunci când se prelucrează materii prime sărace sau polimetalice. Cele mai complexe scheme tehnologice sunt caracteristice pentru producția de metale neferoase.
Conținut
Procesele metalurgice și clasificarea lor
Baza oricărui proces metalurgic este transformarea materiilor prime prelucrate într-un sistem eterogen format din două, trei sau mai multe faze care diferă în compoziție și proprietăți fizice și nu se dizolvă între ele. În acest caz, una dintre faze este îmbogățită de metalul extras și sărăcită de impurități, iar celelalte faze, dimpotrivă, sunt sărăcite de componenta principală.
În practica producției metalurgice se întâlnesc cel mai adesea următoarele combinații de faze: G + G; G + T; G + G; G + G + T; G + G + G + T, unde literele G, G și T desemnează fazele gazoasă, lichidă și solidă.
Separarea sistemelor G + T și G + G + G datorită diferenței mari de densitate se realizează prin sedimentare. Fazele sistemelor G + G care nu sunt solubile între ele pot fi separate și prin sedimentare sau centrifugare Pentru sistemul G + T se aplică sedimentarea, centrifugarea sau filtrarea la temperaturi de până la 400 °C. Sistemele bifazice G + G sunt utilizate în producția chimică, iar sistemele T + T sunt separate prin metode de îmbogățire.
Toate procesele utilizate în metalurgie sunt împărțite în procese pirometalurgice și hidrometalurgice.
Procesele pirometalurgice (din greacă pyr — foc) sunt cele care se desfășoară la temperaturi ridicate, cel mai adesea prin topirea materialului care urmează să fie prelucrat. Procedeele hidrometalurgice (din greacă hydro — apă) se realizează în mediu lichid, la temperaturi care nu depășesc 300 °C. Procesele electrometalurgice se pot referi atât la procesele pirometalurgice, cât și la cele hidrometalurgice, însă diferența dintre acestea constă în utilizarea electricității ca bază energetică pentru desfășurarea lor.
Procese pirometalurgice
Aceste procese pot fi împărțite în trei grupe în funcție de scopul lor, de natura modificărilor fizice și chimice care au loc în ele și de rezultatele finale: prăjirea, topirea și distilarea.
Prăjirea
Acestea sunt în principal procese în fază solidă efectuate la temperaturi de 500-1200 °C pentru a modifica compoziția fazică a materiilor prime prelucrate. Următoarele tipuri de prăjire sunt utilizate în metalurgie:
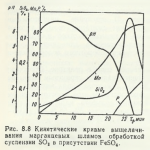
Prăjirea prin calcinare (calcinarea) se realizează pentru a descompune compușii instabili sub influența temperaturilor. Un exemplu al acestui proces este calcinarea magnezitei
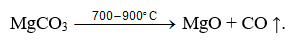
Prăjirea redox este utilizată pentru a reduce parțial componentele materiei prime prelucrate, de exemplu,
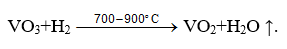
Prăjirea oxidativă este utilizată pentru transformarea totală sau parțială a minereurilor sulfurate și a concentratelor în oxizi. În termeni generali, prăjirea oxidativă este descrisă de următoarea ecuație:
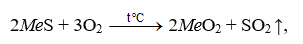
unde Me este Fe, Pb, Zn, Ni etc.
Prăjirea oxidativă include, de asemenea, prăjirea prin sinterizare (prăjirea prin sinterizare), în care materialul sulfurat este simultan oxidat și transformat într-un produs în bulgări puternic — sinter. Sunt utilizate și alte tipuri de prăjire.
Topire
Un proces pirometalurgic efectuat în cuptoare de topire la temperaturi care asigură obținerea produselor de topire în stare topită. Există două tipuri de topire, topirea minereurilor și topirea de rafinare.
Topirea minereurilor
Topirea minereurilor este subdivizată în următoarele tipuri:
Topirea prin reducere este procesul de obținere a metalelor prin reducerea oxizilor acestora cu agenți reducători carbonici sau hidrogen și transformarea deșeurilor în zgură. Multe metale, cum ar fi plumbul, staniolul etc., sunt obținute prin această metodă. Reacția de reducere a oxizilor metalici cu carbon, de exemplu, oxidul de plumb, poate fi scrisă în următoarea ecuație:
Astfel de reacții merg spre dreapta — spre reducerea metalului, dacă puterea legăturii chimice a oxigenului cu carbonul în oxidul de carbon este mai mare decât puterea legăturii oxigenului cu metalul. Forța legăturilor chimice se numește afinitate și este caracterizată în termodinamica chimică prin valoarea potențialului izobar-izoterm, notat prin simbolul ∆Z . Potențialul izobar este măsurat în jouli. Sensul său fizic este lucrul maxim care poate fi efectuat de o reacție. Acest lucru este considerat în mod convențional ca fiind negativ, astfel încât o valoare negativă a lui ∆Z indică caracterul funcțional al reacției — posibilitatea apariției ei spontane.
Afinitatea unui element față de oxigen sau sulf (potențialul izobaric de formare a oxizilor sau sulfurilor) depinde de temperatură. Această dependență este exprimată printr-o ecuație de forma
unde A, B, C — coeficienți determinați din experiență; T — temperatura absolută, °K.
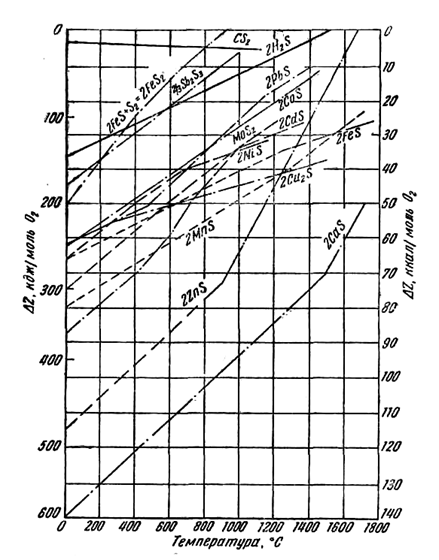
Dependența afinității de temperatură conform acestor ecuații poate fi reprezentată grafic, așa cum se face în (Fig. 4), unde este dată valoarea lui ∆Z pentru un mol de oxigen participant la reacția de formare a oxizilor. Folosind graficul, să calculăm potențialul izobar al reacției de reducere a oxidului de plumb de către carbon la 800°C.
Reducerea PbO poate fi reprezentată prin diferența a două reacții — II și I:
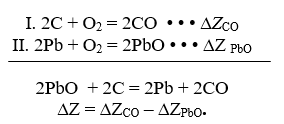
Din graficul din Fig. 4 găsim:
∆Z PBO = — 250 kJ; ∆ZCO= — 400 kJ; ∆Z = — 400 + 250 = — 150 kJ.
Diferența este negativă, prin urmare, reacția va merge spre dreapta, plumbul va fi redus. Liniile de PbO și CO din Fig. 4 se intersectează la o temperatură de aproximativ 320 °C. Dincolo de punctul de intersecție spre stânga, diferența de afinitate va fi pozitivă, acest punct determinând temperatura de început a reducerii plumbului prin carbon.
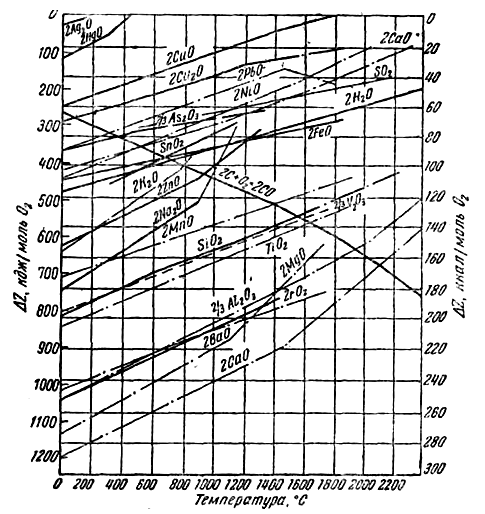
De asemenea, prin punctele de intersecție ale liniilor corespunzătoare este posibil să se determine temperaturile de început ale reducerii altor oxizi de către carbon. Pentru SiO2, Al2O3, CaO, MgO acestea sunt mai mari de 1500 °С.
În consecință, este posibil să se aleagă astfel de temperaturi la care unii oxizi sunt reduși la metal, iar alții rămân neschimbați. Aceasta este baza, de exemplu, pentru topirea plumbului din minereuri care conțin SiO2, FeO, CaO și Al2О3. La topirea minereului cu cocs, numai plumbul, care are o afinitate relativ scăzută pentru oxigen, este redus. Ceilalți oxizi sunt fuzionați în zgură lichidă. Scoria cu o densitate de 3000-3500 kg/m 3 plutește deasupra plumbului lichid ( γ 10000 kg/m 3 ) precum un strat de ulei plutește deasupra apei. Rata de recuperare este foarte importantă: procesele metalurgice trebuie să fie productive, ceea ce presupune ca reacțiile implicate în acestea să se desfășoare rapid.
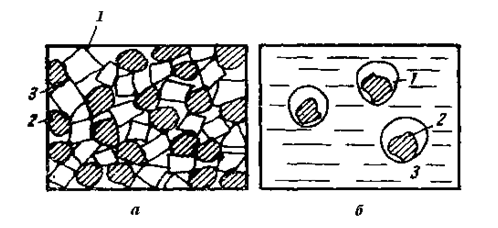
Reducerea oxizilor solizi de către carbonul solid este lentă din cauza suprafeței mici de contact a substanțelor care reacționează. Chiar și la măcinarea fină, particulele de oxid și carbon sunt în contact liber. În plus, produsul de reacție — metalul, care se obține în locurile de contact, oprește reacția în acest punct (fig. 5).
Carbonul solid poate fi un agent reducător energetic numai dacă granulele sale sunt spălate de oxizi lichizi sau în stare de vapori. Cu toate acestea, dacă oxizii sunt în stare solidă, ei sunt rapid reduși de monoxidul de carbon gazos:
Oxidul de carbon se obține prin reacția
În topiturile care nu umezesc bine carbonul, și acestea sunt frecvente, particulele de carbon sunt înconjurate de o peliculă de gaz formată din CO și CO2. Reducerea are loc și aici ca urmare a interacțiunii dintre C și CO2.
Hidrogenul pentru reducerea oxizilor este utilizat mai rar, este mai scump și mai exploziv. Hidrogenul este necesar în cazurile în care carbonul poate forma carburi nedorite cu metalele, de exemplu, în reducerea tungstenului și molibdenului din oxizi prin reacțiile
MoO3 + 3C = Mo + 3CO.
Simultan cu reducerea, se formează carburi de WC și Mo2С.
Multe metale sunt reprezentate în natură prin sulfuri. Pentru a evalua posibilitatea de reducere a sulfurilor cu carbon prin reacția:
Luați în considerare Fig. 6, care caracterizează afinitatea elementelor față de sulf.
În majoritatea cazurilor, carbonul nu este potrivit pentru reducerea directă a metalelor din sulfuri. Hidrogenul nu este, de asemenea, potrivit în acest scop: linia H2S este situată la un nivel ridicat, ceea ce indică imposibilitatea reacției de tip:
În practica metalurgică, sulfurile metalice naturale sunt mai întâi transformate în oxizi, care sunt apoi reduși de carbon. De exemplu, sulfura de plumb galena este oxidată cu oxigen la o temperatură de aproximativ 1000 °C:
Oxidul de plumb rezultat este redus cu carbon.
Prin reacții similare se obține zinc din sulfură. în Fig. 4, linia ZnO prezintă o îndoire care corespunde punctului de fierbere al metalului la 907 °C. Fiind redus la o temperatură de aproximativ 1200 °C, zincul este obținut sub formă de vapori, care sunt scoși din cuptor, răciți și astfel condensați sub formă de metal lichid sau solid (în funcție de temperatura din condensator).
Topirea metalotermală este procesul de obținere a metalelor prin reducerea compușilor acestora cu metale mai active. Se utilizează pentru a produce metale care sunt dificil de redus, cum ar fi tetraclorura de titan TiCl4 și tetrafluorura de uraniu UF4precum și unii oxizi ai metalelor refractare: V2O5, Cg2О3etc. Metalele din acestea sunt reduse de alte metale mai ieftine care au o afinitate mai mare pentru halogen sau oxigen decât metalul redus. Titanul este redus de magneziu prin reacție:
Uraniul este redus de magneziu sau calciu:
iar vanadiul este redus de aluminiu:
Multe dintre aceste reacții au loc cu degajarea unor cantități mari de căldură, care sunt suficiente pentru a topi chiar și metale refractare precum vanadiul, cromul sau manganul. De aici și numele metodei — metalotermie. Pentru a realiza o reacție metalotermică este suficient să se pregătească un amestec de pulberi din substanțele care reacționează și să se aprindă cu un fitil special, de exemplu, din pulbere de magneziu și KClO.3. Amestecul de reacție se aprinde și apoi se topește din cauza căldurii generate de reacție. Aceste procese, care nu necesită încălzire externă, se numesc metalotermie în afara cuptorului. În alte cazuri, când căldura degajată de reacție este insuficientă pentru topire, este necesară aplicarea încălzirii externe în cuptoare, aceste procese se numesc metalotermie de furnal .
Metodele metalotermice sunt costisitoare: pentru a recupera un metal este necesar să se ardă un alt metal; ele sunt utilizate numai atunci când alte metode de recuperare sunt inadecvate.
Topirea mată este procesul de prelucrare a materiei prime de cupru și nichel pentru a extrage metalele într-un semiprodus numit mată (aliaj sulfurat) și pentru a transforma oxizii în zgură.
Acest tip de topire poate fi efectuat în atmosfere neutre, reducătoare și oxidante. În ultimul caz, topirea se numește topire prin concentrare, deoarece permite concentrarea metalului extras într-un volum mai mic de mată bogată (concentrată). Mai jos este prezentată o schemă de topire a materiei prime de cupru pentru mată:
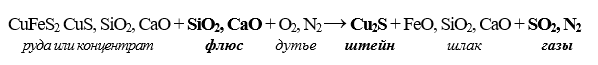
Topirea oxidativă — aceste procese se desfășoară într-o atmosferă oxidantă. Un exemplu de astfel de topire este procesul convertorului de producere a oțelului din fontă brută la o temperatură de 1600 °C. În primul rând, fierul prezent în topitură este oxidat cu degajarea unei cantități mari de căldură
2Fe + O2 = 2FeO + 539800 kJ,
apoi impuritățile sunt oxidate:
Mn + FeO = MnO + Fe;
Si + 2FeO = SiO2 + 2Fe;
topirea prin reacție — aceste procese se bazează pe obținerea metalelor prin reacții chimice între sulfuri și oxizi, de exemplu între sulfura de cupru și oxidul de cupru (I):
Pentru a calcula potențialul izobar al acestei reacții, va trebui să folosim figurile. 4 и 6. Pentru 1200 °C găsim:
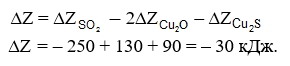
Plumbul este uneori redus din oxizi într-un mod similar la temperaturi de aproximativ 800 °C. Condiția de topire a reacției este afinitatea relativ scăzută a metalelor atât față de oxigen, cât și față de sulf.
Topirea electrolitică (electroliza sărurilor topite ) — procesele se desfășoară sub influența curentului continuu asupra mediului topit format din oxizi sau cloruri. În general, aceste procese sunt descrise prin următoarea schemă:
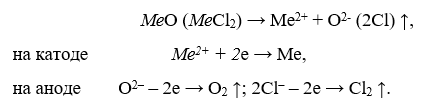
Ca urmare, metalul este eliberat la catod și gazul este eliberat la anod. Electroliza sărurilor topite este aplicabilă oricărui metal, dar, din cauza costului său ridicat, se aplică numai atunci când nu pot fi utilizate alte procedee. În prezent, aluminiul, magneziul și o serie de alte metale ușoare și rare sunt produse prin această metodă.
De exemplu, mineralul de magneziu magnezitul este mai întâi ars pentru a elimina dioxidul de carbon:
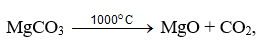
apoi oxidul de magneziu este clorurat:
Clorura de magneziu topită la o temperatură de aproximativ 700 °C este electrolizată. În stare topită, această sare este formată din ioni Mg 2+ și Cl -. La electrodul negativ, catodul, ionii de magneziu câștigă doi electroni și sunt reduși la metal. Punctul de topire al magneziului este de 651 ° C, astfel încât acesta se obține în stare lichidă și, datorită densității mai mici decât electrolitul, plutește deasupra acestuia:
La electrodul pozitiv, anodul, ionii de clor cedează doi electroni pentru a deveni molecule de clor gazos:
Aluminiul este produs prin electroliza oxidului de Al2О3dizolvat în criolit topit Na3AlF6. Oxidul de aluminiu se disociază ca o sare dizolvată în apă:
Criolitul servește doar ca solvent și nu este consumat în timpul electrolizei.
Ca și magneziul, metalele alcaline, calciul și bariul se obțin din topituri de cloruri și fluoruri. Rețineți că reducerea acestor metale cu carbon ar necesita temperaturi foarte ridicate, de peste 1800 °C (a se vedea figura 4).
Rafinarea topirea
Aceste procese sunt efectuate pentru a purifica (rafina) metalele de impurități. Există mai multe varietăți de topire prin rafinare.
- Rafinare oxidativă (la foc) — procesele se bazează pe diferența de afinitate față de oxigen a metalului de bază și a impurităților. Oxizii de impurități rezultați plutesc din topitură în zgură sau se volatilizează în faza gazoasă. De exemplu, această metodă este utilizată pentru rafinarea cuprului blister din sulf.
- Rafinarea prin lichidare este procesul de formare și separare prin densitate (lichidare) a două faze, dintre care una este metalul care urmează să fie rafinat, în timp ce impuritatea este concentrată în cealaltă fază, insolubilă în metalul de bază. Acest tip de rafinare este utilizat pe scară largă în producția de plumb și staniu.
- Rafinarea electrolitică în topituri . Aceste procese se bazează pe transferul metalului rafinat de la un anod lichid la un catod lichid prin intermediul unui strat de electrolit topit și este utilizat pe scară largă pentru rafinarea aluminiului.
- Rafinarea carbonililor — procesele se bazează pe capacitatea unor metale, la anumite temperaturi, de a forma compuși volatili precum Meх (CO)уnumiți carbonili. Un exemplu de astfel de proces este rafinarea nichelului din cupru, care se desfășoară conform schemei:
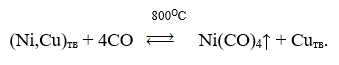
- Distilare — procese de vaporizare a substanțelor atunci când sunt încălzite puțin peste punctul lor de fierbere, permițând separarea componentelor materialului prelucrat în funcție de volatilitatea lor. Aceste procedee sunt utilizate atât în prelucrarea materiilor prime minerale, cât și pentru eliminarea impurităților volatile în rafinarea aliajelor. Distilarea este utilizată în pirometalurgia zincului și în producția de metale ușoare și rare.
Procedee hidrometalurgice
Hidrometalurgie — extracția elementelor din materii prime polimetalice cu ajutorul solvenților în fază lichidă și separarea lor ulterioară din soluții sub formă de metale sau monosedimente.
Procedeele hidrometalurgice sunt utilizate pentru extragerea metalelor din minereuri, concentrate și deșeuri din diverse industrii prin tratarea acestora cu soluții de reactivi chimici în fază lichidă la temperaturi de maximum 300 °C, cu separarea ulterioară a metalelor sau a compușilor acestora din soluțiile rezultate.
Principalele etape ale tehnologiei hidrometalurgice:
- Pregătirea materiilor prime — această etapă contribuie la o levigare mai rapidă, completă și selectivă a metalelor valoroase. Sunt cunoscute metode mecanice (zdrobire, măcinare) și fizice și chimice (calcinare, prăjire, sinterizare, activare hidrotermală etc.).
- Lixivarea este un proces de extracție selectivă a uneia sau mai multor componente ale materiilor prime prelucrate în soluție apoasă sub influența unui solvent, care este utilizat ca apă, soluții de acizi, baze și săruri. Principalele produse ale procesului de levigare sunt soluția care conține metalul extras și reziduul insolubil (turta) care constă în principal în deșeuri de rocă. Există două tipuri de procese de levigare: dizolvarea simplă și dizolvarea cu reacție chimică.
În dizolvarea simplă, metalul extras este transferat în soluție sub forma aceluiași compus în care se afla în materialul sursă. Multe cloruri se dizolvă bine în apă (NaCl, KCl, MgCl2∙KCl∙6H2O) și sulfați (CuSO4ZnSO4).
Lixivierea cu reacție chimică este cel mai comun tip de dizolvare, în care trecerea unui metal în soluție este însoțită de transformarea sa dintr-un compus puțin solubil într-o formă foarte solubilă sub acțiunea solventului. Un exemplu este dizolvarea oxidului de zinc din concentratele arse într-o soluție de acid sulfuric:
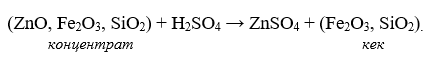
a) purificarea soluției de impuritățile străine prin metode fizice și chimice (precipitare sub formă de compuși insolubili, cementare, separare prin sorbție-extracție)
b) concentrarea soluțiilor prin metode de evaporare, sorbție și extracție cu obținerea ulterioară a fazei apoase îmbogățite prin desorbție și re-extracție.
Purificarea soluției se realizează pentru a reduce pătrunderea impurităților în metal în timpul separării sale ulterioare. În acest scop, se utilizează metode de precipitare chimică cu reactivi organici și anorganici, precum și cimentarea, care se bazează pe principiul deplasării unui metal de către un altul, mai electronegativ. De exemplu,
- Depunerea metalelor din soluții purificate prin levigare se poate realiza prin electroliza soluțiilor apoase, prin cimentare sau prin reducere cu agenți reducători gazoși sub presiune. Pentru precipitarea metalelor sub formă de compuși chimici, se utilizează metode hidrolitice și chimice, precum și evaporarea soluțiilor sau răcirea acestora.
În hidrometalurgia metalelor neferoase, în special a metalelor nobile și rare, procesele de sorbție (schimb de ioni) și extracție devin din ce în ce mai frecvente.
Procesele de schimb ionic se bazează pe capacitatea unor substanțe solide (ionite) de a absorbi ioni din soluție în schimbul ionilor de același semn incluși în compoziția ionitului. Substanțele sintetice cu greutate moleculară mare (rășini schimbătoare de ioni) sunt utilizate ca ioniți.
Extracție — procese de extragere a compușilor chimici dizolvați ai metalelor din soluții apoase într-o masă organică lichidă care nu se amestecă cu apa.