Magneziul metalic a fost obținut pentru prima dată de Davy în 1808. Acesta a electrolizat o soluție apoasă de sare de magneziu cu un catod de mercur și a obținut un amalgam de mercur și magneziu. Prin evaporarea mercurului, el a reușit să izoleze o cantitate mică de metal, care era puternic contaminată cu impurități.
Mai târziu, Bunsen (1852) a izolat magneziul prin electroliza clorurii topite, iar pe baza acesteia, în 1908, a început producția industrială de aliaje de magneziu.
Conținut
Proprietățile magneziului
Magneziul aparține grupei II din sistemul periodic al lui D.I. Mendeleev. Masa atomică a magneziului este de 24,32. Conform proprietăților sale chimice, magneziul aparține metalelor alcalino-pământoase.
Magneziul se topește la 651 ºC și fierbe la 1107 ºC. Magneziul nu prezintă modificări polimorfe și, în întregul interval de temperaturi sub punctul de topire, păstrează o structură hexagonală dens compactă cu raportul axelor c/a (1,6235), aproape egal cu valoarea teoretică (1,633). Diametrul atomic al magneziului este de 0,32 nm. Magneziul este unul dintre cele mai ușoare metale structurale; densitatea sa este de 1,74 g/cm 3 la 20 ºC.
Capacitatea termică specifică a magneziului este aproximativ aceeași cu cea a aluminiului, iar căldura latentă de fuziune este la jumătate. Conductivitatea termică a magneziului este de o dată și jumătate mai mică decât cea a aluminiului, dar mai mare decât cea a oțelului. Coeficienții de dilatare liniară ai magneziului și aluminiului sunt aproximativ identici. Rezistența electrică a magneziului este aproape dublă față de cea a aluminiului. Magneziul este un metal paramagnetic.
Magneziul captează neutroni termici în mod nesemnificativ. Secțiunea sa eficace de captare a neutronilor termici este de 5,9 — 1 0-26 cm 2 .
Modulele Young și de forfecare ale magneziului sunt mici, fiind de numai 44,1 GPa și 17,85 GPa. Ele prezintă o anizotropie notabilă. Magneziul are o ductilitate scăzută la temperaturi scăzute. La temperaturi scăzute, alunecarea are loc numai de-a lungul planurilor de bază (0001). Atunci când este încălzit la 200…300 ºC, în magneziu apar planuri de alunecare suplimentare, iar plasticitatea crește puternic. În toate cazurile, alunecarea se realizează în direcțiile . De asemenea, deformarea plastică se realizează prin îngemănare de-a lungul planurilor . Proprietățile de rezistență ale magneziului la temperatura camerei sunt mai mari decât cele ale aluminiului.
Magneziul este un metal chimic activ. Suprafața proaspătă a metalului este de culoare alb-argintie, dar devine rapid mată din cauza oxidării magneziului în aer cu formarea unei pelicule de oxid. La temperaturi scăzute, pelicula de oxid este amorfă, dar devine cristalină atunci când este încălzită la peste 200 ºC. La temperaturi sub 450 ºC, grosimea peliculei de oxid este mică; aceasta este relativ densă și are anumite proprietăți de protecție împotriva oxidării. La temperaturi mai ridicate, viteza de oxidare a magneziului crește brusc, pelicula de oxid devine liberă, poroasă, astfel încât accesul oxigenului la suprafața metalului este facilitat. Atunci când este încălzit în aer la temperaturi de peste 623 ºC, magneziul se aprinde și arde, emițând o lumină strălucitoare orbitoare. Pelicula de oxid de pe magneziu nu are suficiente proprietăți de protecție deoarece densitatea MgO este mult mai mare decât cea a magneziului.
Magneziul este ușor solubil în toți acizii minerali diluați, cu dificultate — în acidul sulfuric concentrat și nu interacționează deloc cu acidul fluorhidric, reacționează viguros cu mulți acizi organici.
Magneziul este stabil în parafină, benzină, uleiuri minerale, freon, fenol, alcooli (cu excepția alcoolului metilic).
Magneziul dizolvă cantități mari de hidrogen. La temperatura de cristalizare, aproximativ 50 cm 3 /100 g de hidrogen se dizolvă în magneziu lichid și aproximativ 20 cm 3 /100 g în magneziu solid.
Fierul, cuprul, cobaltul, siliciul și nichelul deteriorează puternic rezistența la coroziune a magneziului. Alierea magneziului cu zirconiu și mangan îi crește rezistența la coroziune. Cea mai bună modalitate de a proteja magneziul și aliajele sale împotriva coroziunii este aplicarea unor pelicule subțiri dense de oxid sau a unor straturi subțiri de vopsea pe suprafața produselor.
Aliajele de magneziu sunt sudate în mod satisfăcător prin diferite metode de sudare: sudare cu arc electric cu un electrod de tungsten neconsumabil într-un mediu de protecție cu gaz inert, sudare prin puncte de contact și cu role.
Materii prime pentru producția de magneziu
Magneziul este distribuit în mod semnificativ în scoarța terestră, cu un clark de 2,35 %. O cantitate substanțială de magneziu se găsește în apa mărilor și oceanelor, care conține în medie 0,3 % MgCl2, 0,04 % MgBr2, 0,18 % MgSO4. Conform calculelor aproximative, în hidrosferă există 1,85 — 10 15 tone de magneziu, dar din cauza concentrației scăzute, extracția acestuia din apa de mare este costisitoare și este utilizată în țările sărace în alte tipuri de materii prime (SUA, Norvegia, Anglia).
Compușii fosili de magneziu adecvați pentru producție sunt carnalita KCl — MgCl2 — 6H2O, magnezitul MgCO3 și dolomită MgCO3— CaCO3sunt abundente în subsolul Federației Ruse. În Rusia, aproximativ 80% din magneziu este obținut din carnalit și 20% din magnezit.
Carnalita este o sare fosilă higroscopică care conține potasiu împreună cu magneziu, precum și impurități de clorură de sodiu și bromuri. Minereul extras din subsol se numește rocă de carnalit sau carnalit natural.
Carnalita naturală este supusă îmbogățirii hidrochimice pe baza solubilității mai scăzute a NaCl în comparație cu KCl și MgCl2. Roca zdrobită este dizolvată la 110 ºC într-o soluție circulantă de clorură de magneziu (32 % MgCl2). Principala cantitate de NaCl rămâne sub formă de cristale și se separă pe sită. Soluția este trimisă la cristalizatoare sub vid. Din pasta de cristale obținută aici se separă carnalita artificială în bazine de decantare și apoi se centrifughează. Aceasta are aproximativ următoarea compoziție: 32 % MgCl2; 25 % KCl; 6 % NaCl; 37 % H2O.
Extracția magneziului din carnalita artificială nu depășește 75 %, motiv pentru care se continuă căutarea altor procedee mai favorabile, în special cele bazate pe îmbogățirea mecanică.
Metode de obținere a magneziului
Electroliza clorurii topite
Metoda de electroliză a clorurii topite MgCl2 sau MgCl topit2și KCl a devenit în prezent o practică curentă în lume. În acest scop se utilizează o baie de cărămidă refractară într-o carcasă de oțel. Un anod de grafit este instalat în mijlocul băii, iar două catode de oțel sunt instalate pe laturi. Clorura de magneziu se topește la 718 ºC, topitura sa fiind formată din ioni Mg 2+ și Cl -.
Ionii sunt evacuați la catod:
Magneziul este descărcat sub formă lichidă (punct de topire 651 ºC) și plutește în electrolit, adunându-se la suprafața acestuia; densitatea magneziului lichid este de aproximativ 1,47 kg/m 3 , iar cea a MgCl2 1,68 kg/m 3 .
Clorul este eliberat la anod:
De asemenea, bulele sale plutesc în electrolit. Magneziul și clorul nu trebuie să se întâlnească: aceasta ar duce la combustia magneziului în clor:
Pentru a separa produsele electrolizei în baie, se instalează separatoare ceramice — diafragme. Pentru a preveni pierderea clorului și oxidarea magneziului de către oxigenul din aer, baia este închisă cu un capac ceramic.
Prezența în topitură a clorurilor de metale alcaline — potasiu și sodiu — nu modifică cursul electrolizei: tensiunea de descompunere a acestor săruri este mai mare, astfel încât potasiul și sodiul nu sunt eliberate la catod împreună cu magneziul. Prezența chiar și a unor cantități mici de apă în topitură este nocivă pentru electroliză, deoarece clorura de magneziu este hidrolizată:
Oxidul de magneziu precipită și formează un nămol nedorit pe fundul băii. Impuritățile de sulfat au un efect similar asupra magneziului redus:
Impuritățile de fier sunt reduse mai ușor decât magneziul și îl contaminează. Prin urmare, producția de magneziu prin electroliză necesită clorură de magneziu anhidră, care nu conține apă reziduală, sulfat și fier. Clorura anhidră de magneziu poate fi obținută prin deshidratarea sărurilor naturale — bischofite MgCl2 — 6H2O și carnalit sau prin clorinare a magnezitei.
Sărurile sunt deshidratate prin uscare și retopire. Pentru clorinare, MgCО natural3 natural este ars la o temperatură de aproximativ 700-800 ºC, transformându-se în magnezită caustică prin reacția
Magnezita caustică este amestecată cu cărbune, brichetată și tratată cu clor. Clorura de magneziu anhidră se obține prin reacție
Producerea clorurii de magneziu din magnezită este mai favorabilă decât deshidratarea sărurilor, dacă se poate utiliza clorul din electroliza carnalitului.
Prin urmare, producerea magneziului prin electroliza clorurii topite necesită obținerea prealabilă a clorurii de magneziu anhidră suficient de pură din materii prime naturale.
Metode termice de producere a magneziului
Metoda carbon-termică se bazează pe reacția
Oxidul de magneziu este amestecat cu cocs de petrol fin și brichetat. Brichetele sunt încălzite într-un mediu cu hidrogen, împiedicând accesul aerului, într-un cuptor electric la o temperatură de aproximativ 2500 ºC. Magneziul este produs sub formă de vapori amestecați cu monoxid de carbon.
Amestecul gazos care iese din cuptor este răcit rapid la 120 ºC prin amestecarea sa cu cantități mari de hidrogen sau gaz natural. Răcirea rapidă este necesară pentru „stingerea” gazelor, împiedicând reacția inversă — oxidarea vaporilor de magneziu de către monoxidul de carbon. Magneziul se condensează în praf fin; acesta este colectat din gaze prin colectori de praf și distilat sub vid pentru a produce un metal solid.
Metoda carbon-termică necesită echipamente complexe și costisitoare și este explozivă: praful fin de magneziu este predispus la combustie spontană. Prin urmare, această metodă este rar utilizată în practica modernă.
Metoda silicotermală necesită temperaturi mai scăzute și un echipament mai simplu. Prin această metodă, oxidul de magneziu este redus în vid de ferrosiliciu — un aliaj de fier și siliciu.
În retorte de oțel închise ermetic, încălzite cu electricitate sau gaz până la 1160-1170 ºC, se încălzesc brichete de dolomită caustică și pulberi de ferrosiliciu bine amestecate. Dolomita caustică — un amestec de oxizi CaO și MgO este mai convenabilă pentru metoda silicotermală decât oxidul de magneziu pur: oxidul de calciu inclus în dolomită favorizează recuperarea.
Dolomita caustică se obține prin arderea dolomitei naturale la 1000-1100 ºC în cuptoare rotative tubulare.
Reacția are loc în retortă
2MgO + 2CaO + Si(Fe) → Ca2SiO4 + 2Mg + Fe.
Magneziul este eliminat sub formă de vapori, iar reziduurile de silicat de calciu semimolte și fier rămân în retortă. Vaporii de magneziu, răciți în condensator, dau un precipitat cristalin al metalului.
Această metodă este dificilă și costisitoare din cauza consumului mare de retorte. Chiar și retortele din oțel crom-nichel scump nu sunt durabile. Metoda silicotermală este utilizată dacă nu există depozite de clorură de magneziu.
Producția de clorură de magneziu
Magneziul este utilizat pe scară largă sub formă de aliaje cu aluminiu, zinc și mangan pentru fabricarea pieselor de motoare de avioane și automobile. Aliajele de magneziu au proprietăți bune de turnare, ceea ce face posibilă producerea de piese turnate complexe din acestea. Aliajele sunt ușor sudabile și pot fi prelucrate prin tăiere.
Principalele materii prime pentru producția de magneziu sunt magnezita, dolomita, carnalita și bischofite. Principalul constituent al magnezitei este MgCO3iar dolomita CaCO3 — MgCO3. Carnalita este o clorură naturală de magneziu și potasiu MgCl2 — KCl — 6H2O. Bischofite (MgCl2 — 6Н2O) se obține prin prelucrarea carnalitei sau se evaporă din apa lacurilor și mărilor saline. Cea mai răspândită în prezent este metoda electrolitică de producere a magneziului, în care magneziul este obținut din clorura MgCl introdusă în electrolit în procesul de electroliză.2. Tehnologia de producere a magneziului prin această metodă include trei etape: obținerea clorurii de magneziu anhidră MgCl2, electroliza cu separarea magneziului lichid de clorură, rafinarea magneziului.
Clorura de magneziu se obține prin trei metode. Prima metodă este deshidratarea carnalitei MgCl2 — KCl — 6H2O. Procesul se realizează în două etape. Prima se realizează prin încălzirea carnalitei în cuptoare rotative tubulare sau cuptoare cu pat fluidizat. A doua — în principal în cuptoare-clorinatoare, având o cameră de topire (cuptor cu rezistență), în care carnalita este topită la temperaturi de 550-600 °C, două camere de clorinare, în care impuritățile de clorare (MgO) sunt transformate în MgCl2și o groapă de topire (mixer). La unele uzine, a doua etapă se realizează în cuptoare cu rezistență electrică, unde carnalita este topită la o temperatură de 500 °C și turnată într-un mixer. ~ 500 °C și se toarnă în mixer. În ambele cazuri, carnalita lichidă este turnată din malaxor într-o cuvă și transportată în atelierul de electroliză. Carnalita deshidratată conține, %: MgCl2 47-52; KCl 40-46; NaCl 5-8.
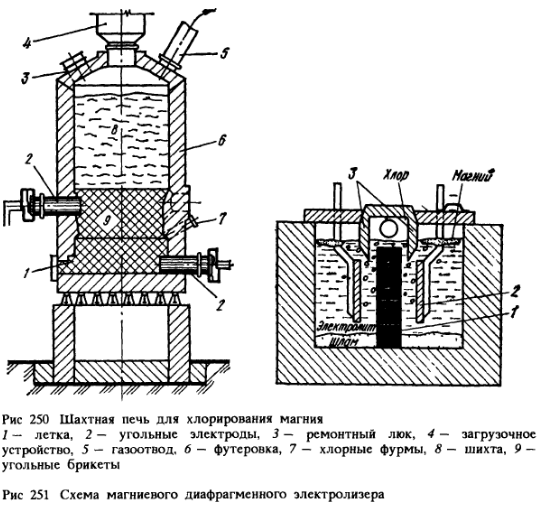
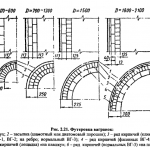
A doua metodă de obținere a clorurii de magneziu constă în clorurarea magnezitei MgCO3 sau oxidul de magneziu obținut prin prăjirea preliminară a magnezitei. Procesul se realizează în cuptoare electrice cu ax. În partea inferioară a cuptorului (fig. 250) sunt amplasate două rânduri de electrozi 2; între aceștia se află brichete de cărbune, care la trecerea curentului electric sunt încălzite până la ~ 750 °С. Sarcina (MgO sau MgCO3) este încărcată de sus, clorul este suflat prin tuyerele 7. La tuyere are loc clorurarea oxidului de magneziu: MgO + Cl2 + C = MgCl2 + CO. Clorura de magneziu se topește și se acumulează pe fund; periodic, este eliberată într-o căldare și transportată la atelierul de electroliză.
A treia metodă este producerea MgCl2 ca produs secundar în procesul de reducere a titanului prin magneziu din TiCl4 (a se vedea mai jos). Această clorură de magneziu lichidă este trimisă la producția de magneziu (magneziul și titanul sunt de obicei produse în aceeași fabrică).
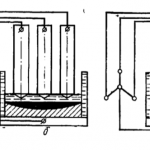
Magneziul este produs electrolitic într-un electrolizor (fig. 251). Plăcile de grafit 7 servesc drept anozi, iar plăcile de oțel 2 drept catozi. Greutatea specifică a magneziului este mai mică decât cea a electrolitului și, prin urmare, magneziul plutește. Clorul eliberat la anod plutește, de asemenea. Pentru a evita interacțiunea clorului cu magneziul, precum și scurtcircuitarea anodului și catodului cu magneziu topit, în partea superioară este instalată o membrană specială de separare 3.
Electrolitul este format din MgCl2 (5-17 %), KCl, NaCl și aditivi CaF2 și NaF. Pe măsură ce MgCl este consumat2 în electrolizor se toarnă periodic carnalită lichidă sau clorură de magneziu. Electroliza se efectuează la 670-720 °C. Magneziul este eliberat la catod: Mg 2+ + 2e → Mg, la anod — clor gazos 2Cl — — 2e → Cl2. Clorul este pompat din electrolizor, iar magneziul lichid este extras de 2-3 ori pe zi cu ajutorul găleților de vid cu încălzire electrică.
Recent, împreună cu electrolizoarele cu diafragmă descrise mai sus, au fost utilizate electrolizoare fără diafragmă.
Rafinarea magneziului se realizează prin decantare în cuptoare, sublimare sau electroliză. Prima metodă este cea mai frecventă și constă în menținerea magneziului în cuptoare cu rezistență sub un strat de fondant. În acest caz are loc sedimentarea (trecerea la precipitat) particulelor de electrolit și a nămolului încâlcit în topitură. Rafinarea prin sublimare se realizează prin evaporarea magneziului în vid la 900 °C. Magneziul pur vaporizat este precipitat într-un condensator. Rafinarea electrolitică a magneziului este similară aceluiași proces de rafinare a aluminiului prin metoda celor trei straturi. În electrolizor, la baza anodului se află un strat de magneziu care urmează să fie rafinat, deasupra — un strat de electrolit, iar deasupra acestuia, la catod, se acumulează magneziu pur.
De asemenea, se utilizează metode termice de producere a magneziului folosind C, Si sau CaC ca agent reducător.2. Dintre aceste metode, mai simplă este metoda silicotermică, care utilizează retorte speciale din oțel crom-nichel rezistent la căldură, plasate într-un cuptor electric încălzit cu combustibil gazos. Ca materie primă, cel mai bine este să se ia dolomita MgCO3 — CaCO3iar ca agent reducător — siliciu ferrosiliciu. Magneziul este obținut cu o puritate ridicată.