Numărul de ordine al beriliului este 4, iar masa sa atomică este 9,013. Beriliul aparține grupei II din sistemul periodic al lui D.I. Mendeleev. Este un metal de culoare gri care seamănă cu oțelul prin aspect.
Beriliul se topește la 1287 ºC și fierbe la 2450 ºC. Are două modificări polimorfe cu o temperatură de transformare alotropică de 1254 ºC. Modificarea la temperatură joasă a beriliului (α-Be) la 18 ºC are o rețea hexagonală cu parametrii a = 0,22856 nm, c = 0,35832 nm, c/a = 1,5677. Modificarea β la temperatură ridicată formează o rețea cubică centrată pe volum cu perioada de 0,2549 nm la 1254 ºC. Distanța interatomică scade în timpul transformării polimorfe α→β, iar densitatea crește cu aproximativ 5 %.
Beriliul are un diametru atomic foarte mic de 0,226 nm. Densitatea sa la 20 ºC este de 0,848 g/cm 3 , care este doar puțin mai mare decât densitatea celui mai ușor material structural, magneziul. Beriliul are o căldură latentă de topire foarte mare, de aproximativ 1625 J/g. Oțelul necesită de 3,3 ori mai puțină căldură pentru a se topi. Căldura latentă de vaporizare a beriliului este neobișnuit de mare (34,4 kJ/g), de câteva ori mai mare decât cea a altor metale (pe unitate de masă). Capacitatea termică specifică a beriliului este de 2,5 ori mai mare decât cea a aluminiului și de 8 ori mai mare decât cea a oțelului. Beriliul este inferior doar argintului, cuprului, aurului și aluminiului în ceea ce privește conductivitatea ectro- și termică. Beriliul are cea mai ridicată temperatură Debye (1463 K) dintre toate elementele (cu excepția carbonului). Coeficientul de dilatare liniară al beriliului este aproximativ același cu cel al fierului.
La temperatura camerei, beriliul este stabil într-o atmosferă uscată, dar se oxidează lent în aer umed. Când este încălzit într-o atmosferă de aer la temperaturi de aproximativ 600 ºC, oxidarea beriliului este neglijabilă. Beriliul metalic reacționează direct cu azotul la temperaturi de peste 700 ºC pentru a forma nitrură Be3N2nitrură, care se caracterizează printr-o duritate ridicată.
Beriliul nu elimină hidrogenul din apă, deoarece pe suprafața sa se formează o peliculă densă de oxid. În apă supraîncălzită la 300 ºC, beriliul tehnic este distrus în două zile. Beriliul este stabil în litiu topit până la 593 ºC, în mercur — până la 315 ºC, în bismut și plumb — până la 673 ºC. Sodiul, potasiul și calciul de puritate tehnică provoacă coroziunea beriliului datorită interacțiunii sale cu oxigenul dizolvat în aceste metale. Dacă conținutul de oxigen din topiturile metalelor alcaline este mai mic de 0,01 %, coroziunea nu are loc.
Conținut
Materii prime pentru producția de beriliu
Beriliul ocupă locul 32 în rândul celorlalte elemente în ceea ce privește abundența; conținutul său în scoarța terestră este de 6-1 0-4 %. Se găsește sub formă de minerale proprii sau ca impuritate izomorfă în alte minerale. Există 54 de minerale de beriliu propriu-zise, dintre care majoritatea sunt slab studiate. Silicații sunt predominanți; se cunosc fosfați, oxizi, antimonați, borați, arsenați și carbonați.
Două minerale industriale sunt utilizate în prezent în străinătate: berilul și berrandita.
Beriliu Be3Al2 [Si6O18] este un silicat cu structură inelară, conținând 10,5-14,3 % BeO. Impuritățile comune sunt elementele alcaline Li, Na, R, Rb, Cs; mai puțin importante sunt Mg, Mn, Fe, Cr, H2O. Beriliul pur este incolor; colorarea sa se datorează impurităților, în special fierului și cromului. Varietățile colorate și bine cristalizate de beril sunt utilizate ca pietre prețioase: smaraldul este verde, acvamarinul este albastru-verzui, sparrowbite (care conține până la 3 % Cs2O) este roz, iar heliodorul este galben.
Beriliul se găsește în aproape toate formațiunile minerale, cu excepția celor magmatice. Însă, pentru utilizarea industrială, până de curând, au fost dezvoltate numai zăcăminte de beriliu cu cristale mari, asociate cu magmatite granitice, care permit utilizarea excavării manuale a minereului. Cererea mare de beriliu a condus la îmbunătățirea metodelor de îmbogățire și la utilizarea altor tipuri de zăcăminte care conțin beriliu fin-cristalin, în special minereuri complexe de spodumene-beriliu.
Cercetările intensive efectuate în ultimii ani în numeroase țări au condus la descoperirea unor noi tipuri industriale de zăcăminte hidrotermale-pneumatolitice. Principalele minerale ale acestor zăcăminte sunt bertrandita, fenakita, crisoberilul, iar în unele cazuri împreună cu acestea sunt prezente bechoita, gadolinita, helvinita și euclasa.
Bertrandita Be4[Si2O7](OH)2— mineralul este incolor, uneori galben pal, conține 39,6-42,6 % BeO; Al 3+ și Fe 3+ sunt uneori prezente ca impurități. Cristalizarea sa are loc într-o gamă largă de condiții de formare a mineralului, dar cu un deficit pronunțat de aluminiu.
Fenakită Be2[SiO4] este un silicat insular, conținând 45,5 % BeO. De obicei incolor, dar uneori colorat de impurități în galben vin sau roz. Înrudit genetic cu bertrandita. Este planificată dezvoltarea zăcămintelor sale în viitorul apropiat.
Chrysoberyl Al2BeO2 conține 18,1-20,7 % de BeO. Este colorat în culori de la verde și galben-verzui la galben-maroniu. Varietatea prețioasă verde smarald a crisoberilului este cunoscută sub numele de alexandrit. Colorarea alexandritului este cauzată de Cr 3+ . Formarea crisoberilului este asociată cu pegmatite și procese hidrotermale-pneumatolitice în condiții de deficit mare de SiO.2. Conținutul de BeO în minereurile exploatate este de la 0,02 la 0,6 %.
În majoritatea zăcămintelor de pegmatite, beriliul face parte din minereuri complexe împreună cu alte minerale de metale rare, iar zăcămintele de bertrandite aparțin celor monometalice. Rezervele confirmate de beriliu sunt mai mari de 1100 mii tone de BeO. Aproximativ 80% din rezerve sunt concentrate în patru țări: Brazilia (380 mii tone), India (180 mii tone), Argentina (70 mii tone) și SUA (55 mii tone).
Minereurile de beriliu sunt dificil de îmbogățit din cauza proprietăților apropiate ale mineralelor de beriliu și ale rocilor reziduale.
Principalele metode de îmbogățire a minereurilor de beriliu sunt următoarele:
Prelucrarea manuală a minereurilor . Acestea sunt utilizate pentru minereurile de beriliu cu cristale mari (dimensiunea minimă a cristalelor trebuie să fie ∼ 10 mm) din zăcăminte de pegmatite, ceea ce face posibilă extragerea a numai 30% din beriliul conținut în minereu. Au fost elaborate metode de zdrobire radiometrică automată a minereurilor, bazate pe radioactivitatea indusă sub iradiere cu raze γ.
Zdrobirea selectivă este utilizată pentru minereurile care conțin roci moi (mica schist, talc). Mineralele solide de beriliu sunt separate de mineralele reziduale cu ajutorul ecranelor sau clasificatoarelor.
Flotarea . Se utilizează pentru minereurile cu fenocristuri fine de beriliu. La valorificarea minereurilor de beriliu spodumene, se efectuează mai întâi flotarea spodumenei. Reziduurile sale, care reprezintă concentratul brut de berili, sunt apoi flotate prin flotare acidă sau alcalină. Metodele de flotare permit recuperarea a ∼ 85 % din beriliu. Îmbogățirea prin flotare a pegmatitelor care conțin mai puțin de 0,1 % BeO a permis obținerea de concentrate cu 8-11,5 % BeO și o recuperare de 70-80 %.
Metode de producție a beriliului
Metode metalotermale
Aceste metode au fost încercate pentru oxidul de beriliu și halogenurile de beriliu. Numai Ca este adecvat pentru reducerea oxidului de beriliu din metalele utilizate în mod obișnuit. Cu toate acestea, produsul de reducere este contaminat cu calciu datorită formării compusului CaBe13. Încercarea de a utiliza Ti și Zr pentru reducere este, de asemenea, nereușită. În acest caz, reacția are loc în fază solidă (punctele de topire ale componentelor sunt foarte ridicate), astfel încât randamentul depinde în mare măsură de gradul de contact al BeO cu agentul de reducere și, prin urmare, brichetarea a fost efectuată la o presiune de 101 MPa. Acest procedeu, realizat în vid profund (133 Pa) și la 1785 ºC, s-a dovedit a fi prea costisitor pentru a fi utilizat pe scară largă.
Toate metalele reducătoare obișnuite sunt aplicabile pentru reducerea fluorurii și clorurii de beriliu. Dintre halogenurile menționate, BeCl este mai puțin adecvat.2 . Este mai dificil de deshidratat, procesul de reducere putând fi efectuat numai sub 550 ºC (punctul de fierbere al BeCl2). Acesta este cu mult sub punctul de topire al metalului, astfel încât beriliul este obținut sub formă de pulbere fină, care se oxidează ușor în timpul descărcării și este dificil de separat de zgură.
Fluorura de beriliu (Tpunct de fierbere=1327 ºC) permite desfășurarea procesului cu producerea de beriliu topit care formează corole metalice. Magneziul este cel mai potrivit agent de reducere, deoarece metalele alcaline, cum ar fi Na, au un punct de fierbere scăzut; în plus, în procesul de reducere se formează un compus NaF — BeF, care nu mai este redus de sodiu, ceea ce reduce semnificativ producția de beriliu.2care nu mai este redus de sodiu, ceea ce reduce semnificativ randamentul de beriliu.
Reducerea termică cu magneziu a fluorurii de beriliu
Aceasta este cea mai comună metodă de obținere a beriliului metalic. Reacția de reducere a fluorurii de beriliu cu magneziu are loc rapid deja la o temperatură de aproximativ 900 ºC, dar pentru a separa produsele de reacție, acestea trebuie încălzite la 1300 ºC, adică peste punctul de topire al fluorurii de beriliu și magneziu. În procesul de reducere se degajă o cantitate mare de căldură, care este utilizată pentru vaporizarea magneziului, ceea ce creează posibilitatea de ejectare a materialului din zona de reacție. Aceste complicații sunt eliminate prin adăugarea de fluxuri, pentru topirea cărora se folosește această căldură. S-a dovedit a fi foarte oportună utilizarea ca flux a excesului de BeF2care exclude contaminarea metalului cu aditivi externi. Sistem MgF2 — BeF2permite alegerea celei mai raționale compoziții a zgurii. Rezultate bune pot fi obținute prin introducerea magneziului într-o cantitate care nu depășește 75 % din necesarul stoechiometric. La un astfel de raport, beriliul se separă ușor de zgură datorită dizolvării de pe suprafața peliculei de oxid a particulelor metalice reduse, împiedicând fuziunea acestora. Densitatea zgurii este mai mare decât cea a beriliului, astfel încât acesta din urmă plutește la suprafața băii.
Reducerea se realizează în creuzete de grafit încălzite în cuptoare cu inducție. Beriliul topit se acumulează pe suprafața zgurii. Când creuzetul se răcește, metalul cristalizează înaintea zgurii, ceea ce face posibilă extragerea lingoului de beriliu din sarea topită. Zgură în stare topită este turnată din creuzet într-o căptușeală de grafit. Sărurile de la suprafața lingoului de beriliu sunt dizolvate în apă. Fluorura de beriliu este extrasă din zgură prin procesul de levigare cu soluție de fluorură de amoniu. Soluția rezultată este introdusă în etapa de producție a fluorurii de beriliu. Nămolul insolubil format din fluorură de magneziu este utilizat ca flux în procesul de reducere după prelucrare. Particulele și bucățile de metal recuperat conțin 97 % Be, precum și o parte din zgură și magneziu nereacționat. Recuperarea totală a beriliului în procesul de reducere este de 96 %, iar durata ciclului este de 3,5 h.
Producerea electrolitică a beriliului
Beriliul nu poate fi produs prin electroliza soluțiilor apoase ale sărurilor sale, deoarece are un potențial de electrod negativ ridicat, astfel încât hidrogenul este eliberat la catod în timpul electrolizei. Producția electrolitică poate fi realizată folosind topituri de săruri, în special topituri de halogenuri de beriliu. Cu toate acestea, topiturile lor nu conduc curentul, astfel încât electroliza este posibilă numai în prezența unui al doilea component cu o conductivitate electrică suficientă și o tensiune de descompunere mai mare decât cea a halogenurilor de beriliu. Aceste proprietăți sunt posedate de halogenurile metalelor alcaline.
Compoziția corespunzătoare a electrolitului permite, în principiu, utilizarea atât a băilor de clorură, cât și a celor de fluorură. Dar punctul de topire ridicat al BeF2 (800 ºC) necesită un proces la temperatură ridicată. Aceasta implică dificultăți constructive și favorizează oxidarea metalului eliberat. Se preferă electroliza la temperatură scăzută dintr-o baie care conține cloruri de beriliu și sodiu. Compoziția optimă a electrolitului a fost găsită prin studierea fuzibilității în sistemul BeCl2— NaCl. Un eutectic la temperatură joasă (215 ºC) conținând 50 % (mol.) BeCl2și compusul cu topire incongruentă Na2BeCl4. În acest compus, beriliul este legat coordinativ de clor, dar legătura este instabilă.
Electroliza se efectuează în băi de nichel sudate, echipate cu un încălzitor electric. Anodul este realizat din grafit dens, ceea ce reduce zgârierea anodului de la suprafață și, astfel, posibilitatea contaminării electrolitului. Catodul este baia de nichel însăși. În acest caz, la sfârșitul electrolizei, electrolitul este pompat într-o altă baie, iar metalul este prelevat cu o lingură perforată. Unele întreprinderi utilizează catozi detașabili sub formă de cutii perforate de nichel introduse în băi. Baia și catodul sunt beriliate înainte de electroliză pentru a reduce contaminarea cu nichel.
Beriliul electrolitic este mai curat decât beriliul metalotermic. Acest lucru se datorează faptului că atât electroliza, cât și clorurarea anterioară a BeO sunt operațiuni de rafinare. Avantajul de mai sus face ca metoda electrolitică să fie competitivă, în ciuda randamentului mult mai scăzut al metalului.
Aliaje pe bază de beriliu
Marea majoritate a elementelor din sistemul periodic au o solubilitate neglijabilă în beriliu sau practic nu se dizolvă în acesta. Elemente precum Co, Ni, Cu, Au, Pd au o solubilitate apreciabilă în beriliu solid la temperaturi ridicate. Cu toate acestea, solubilitatea acestor metale în beriliu scade puternic odată cu scăderea temperaturii și apar precipitații în faza a doua, provocând fragilizarea beriliului.
Aliajele de beriliu cu 20…40 % aluminiu sunt de mare interes. Aceste aliaje se caracterizează prin proprietăți mecanice și tehnologice ridicate, cu o densitate nu mult mai mare decât cea a beriliului. Ele sunt prelucrate mult mai ușor decât beriliul pur. Beriliul formează cu aluminiul o diagramă de stare de tip eutectic cu solubilitate reciprocă practic nulă (fig. 1). Structura aliajelor de beriliu cu 20…40 % Al este reprezentată de particule de beriliu fragile și relativ dure și o fază de aluminiu moale și foarte plastică. Faza de aluminiu conferă aliajelor o prelucrabilitate și o plasticitate suficient de ridicate. Deși aluminiul reduce modulul de elasticitate al beriliului, acesta rămâne suficient de ridicat și atinge 220000…250000 MPa la 25…30 % Al; în acest sens, aceste aliaje depășesc toate materialele structurale prin modulul specific de elasticitate. Promițător pentru aplicații industriale aliajul Be + 38 % Al are σ in = 385 MPa; σ 0,2 = 300 MPa; δ = 7 %; E = 189000 MPa. Proprietățile mecanice ale aliajelor din sistemul Be — Al pot fi crescute semnificativ prin aliere cu magneziu și zinc.
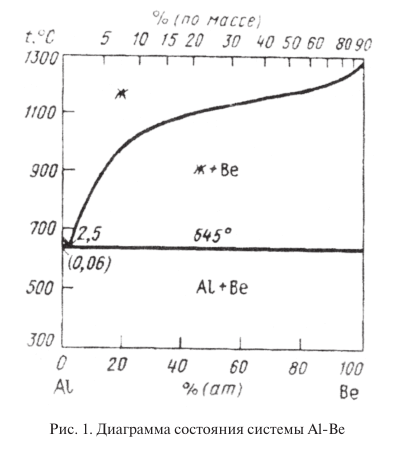
Ca urmare a descoperirii polimorfismului în beriliu, s-au făcut încercări de stabilizare a fazei β la temperatura camerei. Aliajele de beriliu cu faza β stabilizată, datorită structurii lor cubice, ar trebui să aibă o ductilitate considerabil mai mare decât α-beriliul și aliajele bazate pe faza α. Faza β nu este fixată în aliajele de beriliu prin călire în apă. În sistemele de beriliu cu nichel și cobalt, faza β a putut fi fixată numai prin stingere ultrarapidă la viteze de răcire de ordinul a 10 6 deg/s. Prin urmare, stabilizarea fazei β pentru obținerea aliajelor de beriliu este considerată în prezent a fi foarte problematică.