În tabelul Mendeleev, argintul apare sub denumirea latină „Argentum”, deoarece Argentina a fost cea care a descoperit colonizatorilor spanioli zăcăminte uriașe din acest metal prețios. Luați în considerare interacțiunea argintului cu oxigenul și cu alte substanțe care determină proprietățile materialului.
Proprietățile argintului
Produsele realizate din metal gri sau alb-argintiu au intrat de mult timp în viața de zi cu zi sub formă de tacâmuri, ustensile, bijuterii și obiecte de cult. Metalul nobil are o rețea cristalină cubică cu fața centrată. Punctul său de topire este de 961 ℃ și punctul de fierbere este de 2210 ℃. Cu o densitate de 10,5 grame pe centimetru pătrat, este ductil și poate fi bine prelucrat:
- răsucire;
- forjare;
- laminare;
- gravură;
- tăiere;
- polizare;
- tăierea cu diamant;
- îndoire și alte tipuri de prelucrare a metalelor.
Argintul este mai dur decât aurul și mai greu decât cuprul. În ceea ce privește proprietățile chimice, metalul este considerat inert, inactiv, nu dizolvă oxigenul. Formarea plăcii întunecate pe acesta — sulfura de argint, se datorează în primul rând reacției cu particulele de sulf, reprezentate în aer de compusul hidrogen sulfurat. În compoziția altor elemente chimice, argintul este predominant univalent.
Metalul fosil este obținut din șisturi argiloase, parțial exploatate sub formă de pepite. În unele zăcăminte de aur, conținutul de argint în metalul prețios ajunge la 50%, astfel încât acesta poate fi topit într-un cuptor și se pot obține două tipuri de materiale scumpe. În forma sa pură, argintul nu este practic utilizat, cel mai adesea făcând parte din aliaje folosite în special pentru fabricarea bijuteriilor. Spre deosebire de aur, metalul alb nu se dizolvă în „vodca regală” — un amestec de acizi concentrați — nitric și clorhidric.

Oxigenul și argintul
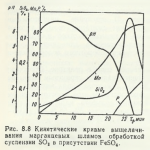
Oxidarea argintului de către oxigen nu are loc în condiții normale. Într-un mediu umed, metalul reacționează lent cu oxigenul și hidrogenul sulfurat: 4Ag + 2H2S + O2, dând compusul 2Ag2S + 2H2O. Cel mai stabil grad de oxidare al metalului este +1, oxidul său fiind Ag2O — o substanță de culoare maro închis care nu reacționează cu apa, dar care atunci când interacționează cu acizii formează săruri, de exemplu, compusul Ag2O + 2NSlO4 dă 2AgSlO4 + H2O. O suspensie apoasă de oxid de argint este capabilă să absoarbă dioxidul de carbon prezent în aer.
Cu un grad de oxidare mai scăzut (+1), argintul prezintă o stabilitate mai mare în compușii chimici. La temperaturi și presiuni normale, metalul este inert nu numai față de oxigen, ci și față de:
- siliciu;
- hidrogen;
- carbonului;
- azotului.
Este posibil să se obțină o peliculă subțire, de numai 12 nm grosime, prin tratament cu plasmă de oxigen, ozon, iradierea metalului cu lumină ultravioletă. Oxigenul dizolvat poate fi dizolvat în argint topit numai în volum de 20 la 1. După solidificarea aliajului, aproape tot oxigenul este deplasat din lingou. Perioada de răcire a unui astfel de lingou este foarte spectaculoasă, însoțită de stropi de metal, dar detonarea este posibilă cu răcire bruscă.