În acest moment, există multe modalități diferite de obținere a hidrogenului dintr-o serie de surse cunoscute, după cum se arată în figura 1.3.
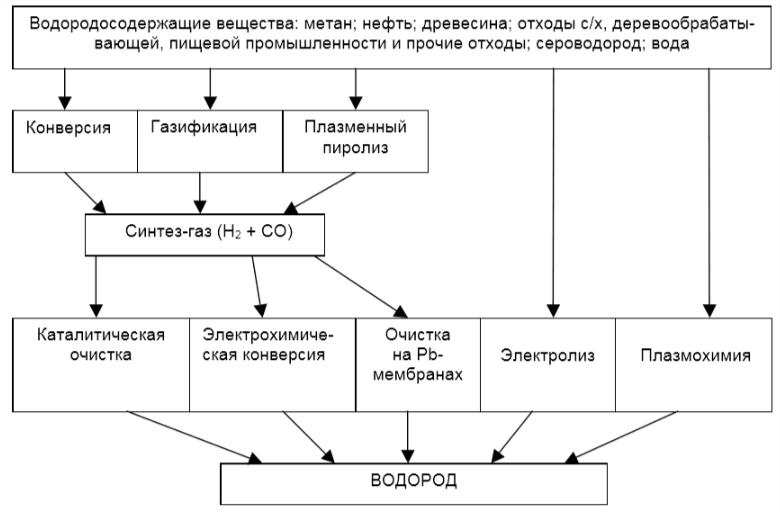
Printre sursele de producere a hidrogenului se numără combustibilii naturali, cum ar fi metanul, cărbunele, lemnul, produsele petroliere și gazele combustibile produse de om. Atunci când combustibilul interacționează cu vaporii de apă sau cu aerul, gazul de sinteză — un amestec de CO și H2. Hidrogenul este apoi eliberat din acesta. O altă sursă sunt deșeurile agricole, din care se produce biogaz și apoi gaz de sinteză. De asemenea, deșeurile industriale sunt utilizate pentru a produce gaz de sinteză, ceea ce contribuie, de asemenea, la rezolvarea problemelor de mediu, deoarece există multe deșeuri și acestea trebuie eliminate. În final, sunt produse dioxid de carbon, hidrogen și monoxid de carbon.
Următoarea etapă este purificarea catalitică, conversia electrochimică etc. Un element foarte important în conversia gazelor care conțin hidrogen este purificarea gazelor pe membrane de paladiu. În final, se obține hidrogen pur. Hidrogenul poate fi produs și prin electroliza apei, adică descompunerea apei sub influența curentului electric din diferite surse de energie. Generatorul eolian, celulele fotovoltaice, rețeaua de curent alternativ și energia solară, care sunt surse regenerabile, sunt utilizate pentru a genera energie electrică. Hidrogenul produs este ulterior introdus în sisteme de stocare sau transportat la consumatori.
Conținut
- Tehnologii de producere a hidrogenului
- Metode de producere a hidrogenului
- Compararea tehnică și economică a metodelor de producere a hidrogenului
- Utilizarea energiei nucleare pentru producerea hidrogenului
- Costuri
Tehnologii de producere a hidrogenului
În prezent, au fost dezvoltate numeroase metode de producere a hidrogenului.
Pentru a obține hidrogen nu este necesară extragerea acestuia, ci ruperea legăturilor chimice din hidrocarburi sau apă și separarea acestuia din amestecul de reacție. Un dispozitiv de producere a hidrogenului este reformatorul cu abur, pentru care există diferite opțiuni de alimentare. Figura 1.4 rezumă opțiunile de alimentare pentru reformer.
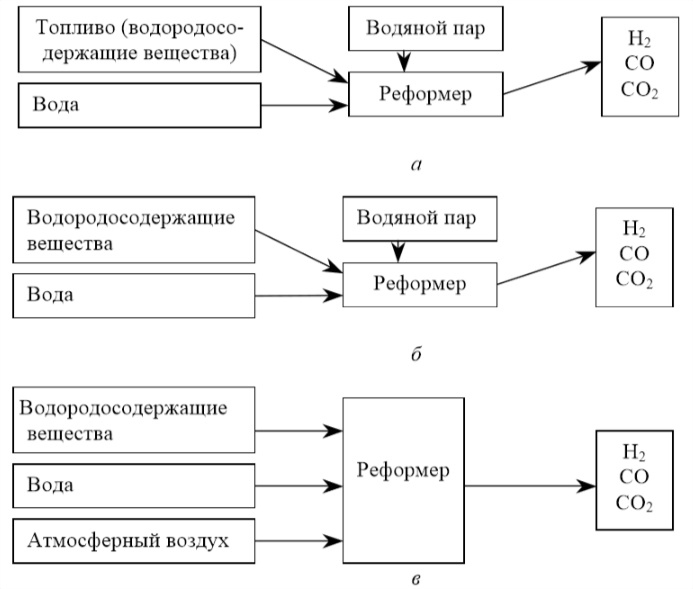
Figura 1.4, a prezintă o variantă a sursei de alimentare a reformatorului în conversia cu abur. În conversia cu abur, combustibilul reacționează cu apa și temperatura ridicată pentru a produce hidrogen. Parțial oxidat, combustibilul reacționează cu aerul pentru a crea o temperatură ridicată în cadrul procesului, așa cum se arată în figura 1.4, b. Conversia autotermică (figura 1.4, c) combină cele două procese.
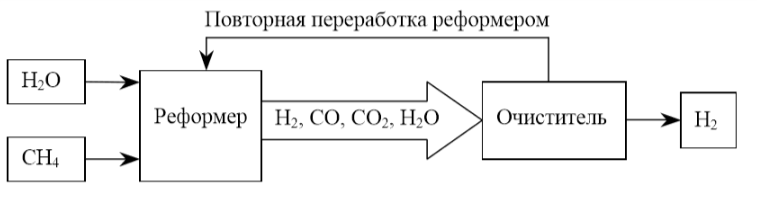
Figura 1.5 prezintă modelarea modulelor de producere, purificare și comprimare a hidrogenului.
Metode de producere a hidrogenului
Conversia gazelor naturale
În prezent, producția pe scară largă de hidrogen și de produse care conțin hidrogen se realizează la nivel mondial în principal prin conversia cu abur a metanului, care este principalul component al gazelor naturale și conține 25% hidrogen. Separarea hidrogenului de coloana vertebrală de carbon din metan necesită abur și energie termică la temperaturi de 750-850 °C, ceea ce se întâmplă în reformatoarele chimice cu abur pe suprafețe catalitice.
Prima etapă a reacției separă metanul și vaporii de apă în hidrogen și monoxid de carbon (gaz de sinteză):
Randamentul de hidrogen crește datorită reacției suplimentare a CO cu apa la temperaturi reduse în prezența catalizatorilor. „Reacția de forfecare” transformă monoxidul de carbon și apa în dioxid de carbon și hidrogen:
Această reacție are loc la temperaturi de 200-250 °C.
La realizarea reacțiilor specificate se poate extrage aproximativ 96 % din hidrogen, iar căldura necesară procesului este obținută prin arderea unei părți din gazele naturale. Productivitatea acestor instalații atinge 4-12 mii m 3 de hidrogen pe oră.
Pentru a economisi gazele naturale și pentru a reduce poluarea mediului cauzată de produsele de ardere a acestora, Rusia, SUA și Japonia au dezvoltat și continuă să dezvolte tehnologia de conversie a gazului metan cu abur, cu alimentare cu căldură de la un reactor cu heliu de înaltă temperatură (HTGR). Reactoarele de înaltă temperatură cu agent de răcire cu heliu sunt capabile să producă căldură la o temperatură de aproximativ 1 000 °C, care poate fi utilizată pentru a produce electricitate cu randament ridicat într-un ciclu direct cu turbină cu gaz și pentru a furniza căldură la temperatură ridicată și electricitate proceselor de producție a hidrogenului, proceselor tehnologice din industria chimică, rafinarea petrolului, industria metalurgică și alte industrii, precum și desalinizarea apei. Un astfel de complex constă dintr-o parte nucleară care produce gaz de sinteză, care este transportat la partea tehnologică de producție, unde este utilizat pentru a produce produse finale.
De asemenea, pot fi utilizate reactoare rapide cu metal lichid. De exemplu, reactorul rusesc BN-600 în funcțiune are parametri de vapori la ieșirea din RBN (13,2 MPa și 500 °C) apropiați de cei necesari pentru conversia metanului.
Pentru a obține conformitatea deplină a temperaturii aburului cu temperatura de funcționare de 850 °C, se propune încălzirea suplimentară a amestecului vapori-gaz prin arderea unei părți din gazul natural furnizat reformatorului.
În viitor, în cazul creării reactoarelor rapide de temperatură ridicată (800-850 °C) cu agent de răcire cu plumb, ponderea combustibilului carbonic ars poate fi redusă sau înlocuită complet cu căldură nucleară.
Studii privind conversia în plasmă a metanului în gaz de sinteză au fost efectuate la RRC „Institutul Kurchatov”. Această tehnologie poate fi aplicată la stațiile de realimentare sau la bordul vehiculelor cu hidrogen care utilizează combustibil lichid sau gazos convențional.
În prezent, conversia cu abur a metanului este cea mai rentabilă modalitate de a produce hidrogen.
În ultimii ani, o atenție deosebită a fost acordată unei alte surse naturale importante de metan — oceanele lumii. Atunci când metanul, care se ridică din interiorul Pământului, întâlnește apa care s-a infiltrat prin crăpături în scoarța terestră, acesta se răcește imediat. Se formează o substanță asemănătoare gheții, hidratul de metan. Aceasta este o substanță combustibilă, iar rezervele sale le depășesc pe cele de petrol, cărbune și gaze naturale la un loc.
Odată cu epuizarea combustibililor convenționali, ar putea juca un rol foarte pozitiv în sectorul energetic, însă utilizarea sa ar putea duce la schimbări climatice. Rezervele de hidrați de metan nu numai că sunt greu accesibile, dar prezintă și riscul unei eliberări bruște și necontrolate de metan la suprafața oceanului în cazul în care echilibrul extern și intern rămas în ele este perturbat. Un astfel de risc există chiar și în condițiile unor procese naturale și este în creștere din cauza încălzirii globale.
Gazeificarea cărbunelui
Gazeificarea este un proces de interacțiune la temperatură ridicată a fosilelor combustibile, în cazul de față — cărbunele, cu vapori de apă, oxigen, dioxid de carbon sau amestecurile acestora pentru a produce gaze combustibile: Н2CO, CH4. Acestea pot fi utilizate ca și combustibil și ca materii prime pentru industria chimică. Aproape toate tipurile de combustibili gazoși, lichizi și solizi pot fi gazeificați. Alegerea materiei prime pentru proces este de obicei determinată de considerente economice și, uneori, de direcția de prelucrare ulterioară a amestecului gazos rezultat.
Procesele în care se formează amestecuri de produse de gazeificare sunt foarte diverse și constituie un sistem complex de reacții secvențiale-paralele, reversibile și ireversibile, printre care există atât reacții exo- cât și endotermice.
Se consideră că reacțiile de gazeificare propriu-zise sunt precedate de piroliza cărbunelui cu eliberarea de substanțe volatile și formarea de reziduuri solide carbonizate (cocs). Agenții de gazeificare reacționează apoi cu produșii gazoși de piroliză și cu particulele de cocs. Majoritatea acestor reacții sunt reversibile, cu excepția reacțiilor oxidative care implică oxigen molecular.
În prezent, metoda de producere a hidrogenului din apa și gazele de abur-aer obținute prin gazeificarea cărbunelui este foarte răspândită. Procesul se bazează pe conversia monoxidului de carbon. Apa gazoasă conține până la 50 % H2 și 40 % CO; în gazul de vapori, în plus față de H2 și CO, există o cantitate semnificativă de N2care este utilizat împreună cu hidrogenul produs pentru sinteza NH.3. Hidrogenul se extrage din gazul de cocserie prin îndepărtarea celorlalte componente ale amestecului gazos, care se lichefiază mai ușor decât hidrogenul la răcire profundă.
Procesul de transformare a combustibililor solizi în gaz combustibil este cunoscut încă din 1670. În ultimii 150 de ani, tehnologia de gazificare a atins un nivel ridicat și este dezvoltată pe scară largă. În prezent, există mai mult de 70 de tipuri de procese de gazeificare, dintre care unele sunt utilizate la scară industrială. Aceasta se explică în primul rând prin diferența dintre proprietățile fizice și chimice ale cărbunelui din diferite zăcăminte: prin compoziția elementară, originea, conținutul de substanțe volatile, conținutul și compoziția cenușii, umiditatea, raportul H/C în masa cărbunelui, sinterizabilitatea cărbunilor, rezistența lor termică. Nu mai puțin semnificativă este diferența de compoziție fracționată a cărbunelui extras: cărbune grosier, fine de cărbune, praf de combustibil.
În cele din urmă, cerințele pentru produsul final diferă:
- gaz generator (de putere) cu o putere calorifică de 3800-4600 kJ/nm 3 ;
- gaz de sinteză (gaz de proces) pentru tehnologia chimică cu o valoare calorifică de 10 900-12 600 kJ/nm 3 ;
- gaz reducător (pentru producția metalurgică și construcția de mașini) cu o putere calorică de ardere de 12.600-16.800 kJ/nm 3 ;
- gaz de oraș (gaz de încălzire) cu o putere calorifică de 16.800-21.000 kJ/nm 3 ;
- gaz natural sintetic (bogat) pentru transportul pe distanțe lungi — 25.000-38.000 kJ/Nm 3 .
Cu toată diversitatea lor, procesele de gazeificare se împart în două clase principale:
- Procedee de gazeificare autotermală , în care căldura necesară pentru procesele endotermice, pentru încălzirea materialului de gazeificare și a mijloacelor de gazeificare la temperatura de gazeificare (900-1200 °C), este produsă prin arderea în oxigen a unei părți din combustibilul gazeificat în dioxid de carbon. În procesele autotermice, arderea unei părți a combustibilului și gazeificarea se desfășoară împreună într-un singur volum generator de gaz.
- Procesele alotermice de gazeificare, în care arderea și gazeificarea sunt separate, iar căldura este furnizată printr-un perete de transfer de căldură în cadrul unui singur volum de generator de gaz sau prin intermediul unui agent de răcire încălzit autonom care este introdus în mediul de gazeificare pentru a asigura desfășurarea procesului de gazeificare.
Atât procesele de gazeificare autotermică, cât și cele aloterme, în funcție de granularitatea combustibilului, pot avea loc în straturi dense și „fierbinți” (combustibil în bucăți grosiere), în flux de aerosoli (praf de combustibil). Aceste principii ale proceselor eterogene dezvoltate în tehnologia generatoarelor de gaze au fost utilizate pe scară largă în tehnologia chimică în realizarea, de exemplu, a proceselor catalitice eterogene.
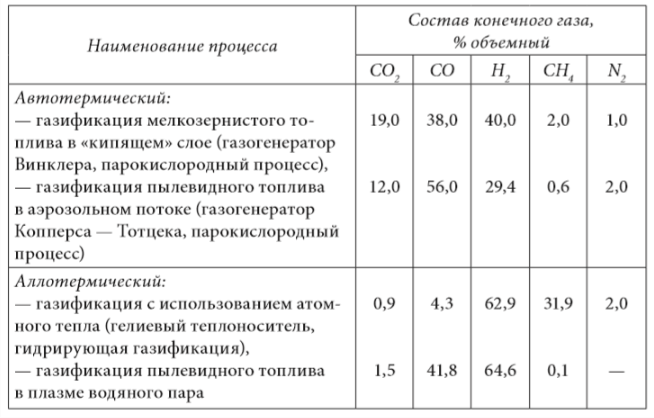
Compozițiile tipice ale gazelor obținute în procesele autotermice și aloterme sunt prezentate în tabelul 1.4.
Gazeificarea subterană a cărbunelui
Emisiile de la centralele termice pe cărbune pot conține elemente radionuclidice naturale. Aceste elemente radioactive sunt prezente și în cenușa emisă prin coșuri împreună cu gazele de ardere. Dacă gazele de ardere sunt curățate de cenușă cu o eficiență de 98,5 %, ceea ce se întâmplă doar la unele dintre cele mai moderne centrale termice și este un proces foarte costisitor, atunci chiar și în acest caz doza de radiații datorată radionuclizilor naturali din emisiile centralelor termice va depăși de 5 și chiar 40 de ori doza similară primită de populația care locuiește în apropierea centralelor nucleare de aceeași capacitate.
Se poate presupune că singura metodă care va oferi posibilitatea de a utiliza zăcămintele de cărbune pentru producerea de căldură și energie electrică cu o mai mare siguranță radiologică este punerea în aplicare a ideii lui Ramsay-Mendeleev privind gazeificarea subterană a cărbunelui și purificarea gazelor obținute în generatoarele de gaze subterane.
Avantajul gazeificării subterane este, de asemenea, acela că elimină munca grea și foarte dăunătoare a minerilor. Transportul, încărcarea, descărcarea și zdrobirea cărbunelui, care necesită costuri energetice ridicate și poluează mediul cu praful de combustibil, sunt înlocuite de transportul simplu și inofensiv al gazului combustibil purificat către locurile de utilizare directă a acestuia. Gazeificarea subterană este, de asemenea, preferabilă din punct de vedere ecologic exploatării cărbunelui la suprafață în minele de cărbune, deoarece aceasta din urmă perturbă stratul superior al Pământului. În cele din urmă, gazeificarea subterană oferă oportunități ample pentru automatizarea proceselor.
Producerea hidrogenului din amoniac
Reacția de disociere termocatalitică a amoniacului este de forma:
Această reacție se caracterizează printr-un randament destul de ridicat de hidrogen (aproximativ 17,6 %) per kilogram de amoniac. Conținutul masic de hidrogen pe unitatea de volum de amoniac lichid este de 1,5 ori densitatea hidrogenului lichid. Amoniacul este depozitat convenabil în rezervoare în stare lichidă, la temperatura maximă de 32 °С, sub o presiune scăzută de aproximativ 1,5 MPa.
Descompunerea amoniacului începe la 270 °C, iar la 900 °C se disociază aproape complet.
În instalațiile de producere a hidrogenului prin disocierea amoniacului, se utilizează catalizatori de oxid de fier, iar procesul se desfășoară la o temperatură de 600-700 °C. Ca urmare a disocierii, se obține un amestec gazos cu un conținut volumic de 75 % H2 și 25% N2 la presiune atmosferică. Consumul de energie pentru reacție este de 25-27 % din căldura inferioară de ardere a hidrogenului obținut.
Obținerea hidrogenului din metanol
Reacția de descompunere endotermică a metanolului are loc cu ajutorul unui catalizator eterogen la temperaturi cuprinse între 500-700 °C și este descrisă de ecuația:
Randamentul specific de hidrogen al acestei reacții este de 0,125 kg/kg CH3OH. Deoarece densitatea metanolului atinge aproximativ 700 kg/m 3 , producția volumetrică de hidrogen va fi de 87 kg/m.
Pentru a produce hidrogen din metanol se poate utiliza un proces de conversie cu abur:
De obicei, pentru acest proces se utilizează un catalizator zinc-crom. Procesul se desfășoară la 573-673 K. Metanolul poate fi utilizat drept combustibil pentru procesele de conversie. În acest caz, eficiența procesului de producere a hidrogenului este de 65-70 % (raportul dintre căldura hidrogenului produs și căldura de ardere a metanolului consumat); dacă căldura pentru procesul de producere a hidrogenului este furnizată din exterior, căldura de ardere a hidrogenului produs prin descompunere catalitică este cu 22 % mai mare decât căldura de ardere a metanolului consumat, iar căldura de ardere a hidrogenului produs prin conversie cu abur este cu 15 % mai mare decât căldura de ardere a metanolului consumat.
Trebuie adăugat că, la crearea unui sistem tehnologic energetic cu utilizarea căldurii reziduale și a hidrogenului obținut din metanol, este posibil să se obțină o eficiență mai mare a procesului decât în cazul utilizării acestor produse ca combustibili lichizi sintetici. Astfel, la arderea directă a metanolului într-o unitate de turbină cu gaz, randamentul este de 35 %, la realizarea, pe seama căldurii gazelor reziduale, a evaporării și conversiei catalitice a metanolului și a arderii unui amestec de CO + H2 eficiența crește până la 41,30 %, iar la efectuarea conversiei aburului și arderii hidrogenului obținut — până la 41,9 %.
Principalul dezavantaj al utilizării metanolului ca sursă de hidrogen este toxicitatea metanolului.
Producerea hidrogenului din hidruri și borohidruri metalice
Hidroliza hidrurilor și borohidrurilor metalelor ușoare este o metodă foarte eficientă de producere a hidrogenului din stare legată. Tabelul 1.5 prezintă datele corespunzătoare pentru compușii a căror producție industrială pilot poate fi considerată stăpânită.
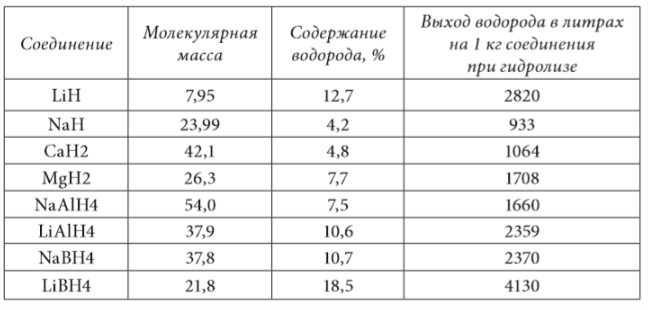
După cum rezultă din analiza datelor date, cel mai mare randament de hidrogen se observă în hidroliza borohidridelor de litiu LiVH4. Cu toate acestea, utilizarea acestei substanțe este practic exclusă din cauza riscului ridicat de incendiu cauzat de activitatea chimică semnificativă.
Hidrură de litiu LiH este următorul element în ceea ce privește cantitatea de hidrogen eliberată. Deoarece densitatea hidrurii de litiu compacte este de aproximativ 600 kg/m, iar cea a borohidridei de sodiu NaBH4 — 1074 kg/m 3 , cele trei hidruri — LiH, NaBH4 și LiAlH4 — sunt aproximativ echivalente. Celelalte hidruri sunt semnificativ inferioare compușilor de mai sus în ceea ce privește masa specifică și randamentul volumetric de hidrogen.
Metode de producere a hidrogenului din apă
Obținerea hidrogenului din apă prin descompunerea sa de către metalele hidroreactive
Atunci când metalele hidroreactoare interacționează cu apa, este eliberat hidrogen. Randamentul de hidrogen în aceste reacții este destul de ridicat, iar utilizarea anumitor metale poate prezenta un interes practic.
Tipul de reacție depinde de cantitatea de apă și, la rândul său, de metrii de abur de lucru ai reactorului (exces de apă față de coeficientul stoechiometric, presiune, temperatură).
Reacția (a) are loc la T = 250 °C, P = 8 MPa. Viteza medie de oxidare a pulberii de aluminiu este insuficientă pentru a crea un reactor adecvat pentru utilizarea în centralele electrice.
Reacția (b) are loc la temperatura T = 300-350 °C, P = 16-18 MPa. Reacția se desfășoară suficient de rapid și poate fi reglată. Produsul reacției, pe lângă hidrogen, este o pulbere cu particule de 1 până la 5 microni, care nu se lipesc între ele.
Reacția (c) are loc la o temperatură de peste 300-350 °C, presiunea P = 20-30 MPa. Produsul reacției, în afară de hidrogen, este o pulbere constituită în principal din Al2O3care poate forma aglomerate solide, puțin solubile în apă și care se depun pe pereții conductelor. Procesul este dificil de controlat și periculos. Analiza acestor procese ne-a permis să ne oprim asupra reacției (b).
Deoarece viteza de reacție crește odată cu creșterea gradului de dispersie a pulberii, este de dorit să se obțină o dispersie cât mai mare posibil. Clasele de pulberi stăpânite de industria națională sunt prezentate în tabelul 1.6.
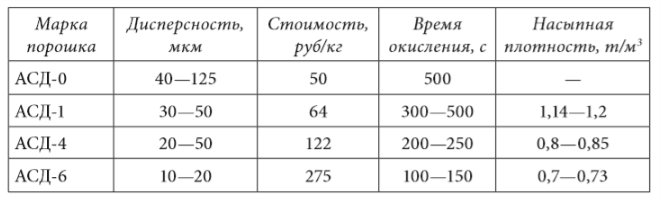
Randamentul masic specific al hidrogenului, raportat la 1 kg de metal, este, conform ecuațiilor de mai sus, aproximativ egal cu 11,1 % pentru aluminiu. Aceasta este de aproximativ 2-3 ori mai mică decât valorile similare pentru cele mai bune hidruri.
Rezultatele prezentate arată că, pentru instalațiile de transport, această metodă este dificil de realizat din cauza caracteristicilor masei-dimensiuni nesatisfăcătoare și a complexității schemei tehnologice a instalației.
Descompunerea termochimică a apei
Descompunerea apei numai prin căldură, fără utilizarea muncii, implică un proces la temperaturi foarte ridicate (peste 3000 °C). Cu toate acestea, prin legarea apei într-o anumită stare intermediară cu eliberarea de oxigen și cu o descompunere termică ulterioară, este posibilă scăderea temperaturii acestui proces.
Aceasta este baza metodelor termochimice de producere a hidrogenului, care constau în desfășurarea secvențială a mai multor reacții chimice, dintre care unul dintre produsele finale este hidrogenul. Natura în mai multe etape a procesului îl face dificil de pus în aplicare la scară industrială largă. Avantajul său este că nu necesită energie electrică și se realizează la temperaturi relativ scăzute. În plus, toți reactivii intermediari din astfel de cicluri, cu excepția apei, sunt regenerați din aportul de căldură, ceea ce face combustibilul hidrogen mai ieftin.
Interesul pentru utilizarea ciclurilor termochimice se explică prin perspectiva obținerii unui randament suficient de ridicat (50-60%) ca urmare a utilizării directe a căldurii provenite de la un reactor nuclear de înaltă temperatură, ocolind etapa de conversie a căldurii în energie electrică.
Cu toate acestea, implementarea cu succes a descompunerii termochimice a apei necesită cercetări suplimentare în domeniul științei materialelor, deoarece în prezent această problemă nu a fost rezolvată definitiv.
Electroliza apei
Descompunerea apei pentru a forma hidrogen și oxigen gazos prin trecerea unui curent electric prin apă a fost realizată pentru prima dată de Ritter în 1801.
Din cauza conductivității specifice scăzute a apei pure, electroliza sa directă este ineficientă, astfel încât în practică se utilizează de obicei o soluție apoasă de KOH. Acest alcalin are o conductivitate specifică bună, care la temperaturi normale și la o concentrație de 20-40% atinge 0,3-0,5 Ohm∙c m-1 , adică de 10 7 ori mai mare decât în cazul apei pure.
Într-o soluție alcalină, concentrația ionilor de hidrogen este mică, ca urmare deficitul lor la catod este compensat prin disocierea moleculelor de apă sau descărcarea lor directă cu formarea de atomi de hidrogen și ioni OH cu recombinarea ulterioară a hidrogenului atomic în molecule:
2Н2O + 2e + Me → H2 + OH- + Me,
unde Me este metalul catodului.
Eliberarea oxigenului la anod are loc ca urmare a descărcării ionilor de hidroxil sau a moleculelor de apă prin reacții:
Principalii purtători de curent în KOH sunt ionii pozitivi K + și ionii hidroxil OH — .
Recent, electroliții solizi pe bază de membrane schimbătoare de ioni, în care conductivitatea electrică este asigurată de ioni de hidrogen sau oxigen, au fost utilizați activ în electroliza apei. Această metodă de descompunere a apei se numește electroliza apei cu electrolit polimer solid și prezintă o serie de avantaje incontestabile față de electroliza convențională a apei.
Electroliza apei utilizând un electrolit solid-polimeric (SPE) este una dintre cele mai promițătoare metode atât pentru producția industrială de hidrogen la scară largă, cât și pentru o gamă largă de aplicații speciale.
Avantajele acestei metode includ
- distanță mică între electrozi (grosimea membranei polimerice schimbătoare de ioni 50-300 μm);
- rezistivitatea destul de scăzută a electrolitului (4- 20 Ohm∙c m-1 );
- excluderea separatoarelor suplimentare de gaze.
Piroliza biomasei
Procesul de piroliză poate fi utilizat pentru a produce hidrogen din biomasă, însă biomasa trebuie mai întâi tratată la temperatură și presiune ridicate. Aceste tratamente dezmembrează și oxidează parțial biomasa, care este ulterior purificată. Procesul complet este similar cu gazeificarea cărbunelui, dar necesită totuși un pretratament. Organismele biologice producătoare de hidrogen sunt, de asemenea, utilizate pentru a produce hidrogen. Principalele sunt algele marine și bacteriile. Algele marine folosesc enzima reversibilă hidrogenază pentru a produce hidrogen din protoni în condiții anaerobe.
Conversia în plasmă a hidrocarburilor
Centrul rus de cercetare Institutul Kurchatov a efectuat cercetări privind conversia în plasmă a combustibililor naturali din hidrocarburi (metan, parafină în gaz de sinteză). Această tehnologie poate fi aplicată la stațiile de realimentare sau la bordul vehiculelor cu hidrogen atunci când se utilizează combustibil lichid convențional. De asemenea, au fost dezvoltate metode plasmă-chimice de producere a hidrogenului cu ajutorul tehnologiilor de înaltă frecvență și ultraînaltă frecvență, folosind ca materii prime compuși chimici în care hidrogenul este într-o stare slab legată, de exemplu hidrogenul sulfurat.
Compararea tehnică și economică a metodelor de producere a hidrogenului
Dintre metodele de producere a hidrogenului menționate mai sus, cele mai acceptabile în scopuri de inginerie energetică sunt metodele de producere a hidrogenului din tipuri de materii prime precum metanul, derivații hidrocarburilor petroliere (motorină, benzină), combustibilul artificial — metanolul, în viitor — huila. O metodă de producere a hidrogenului mai curată din punct de vedere ecologic, dar mai intensivă din punct de vedere energetic — electroliza apei — concurează cu aceste metode.
Pentru a evalua eficiența economică comparativă a metodelor de producție a hidrogenului, este necesar să se determine principalii indicatori comparabili: investițiile de capital, costurile anuale de producție și costul unitar de producție, perioada de recuperare a investițiilor de capital suplimentare și costurile reduse. Calculele tehnice și economice ar trebui efectuate în conformitate cu anumite condiții de comparabilitate energetică și economică a variantelor luate în considerare, atât în ceea ce privește volumul de producție, cât și metoda de calcul. Trebuie îndeplinite următoarele cerințe:
- asigurarea aceluiași efect de producție pentru consumatorul de hidrogen;
- să se ia în considerare modificarea costurilor în sectoarele conexe ale economiei naționale (inclusiv costurile de extracție și transport ale materiilor prime în condițiile comparate)
- să optimizeze fiecare dintre variantele comparate în ceea ce privește proiectarea și modul de funcționare;
- să asigure unitatea metodelor de calcul pentru toate cazurile de alegere a variantei optime (planificare, proiectare, exploatare, construcție, reconstrucție etc.)
- să prezinte indicatori economici care să reflecte caracteristicile calitative și cantitative ale fiecărei opțiuni în termeni valorici;
- găsirea soluției optime prin compararea unui număr de rezultate posibile interschimbabile;
- utilizarea ca principal criteriu de evaluare a eficienței economice a acestei soluții a costurilor actuale sau a costurilor pentru întregul ciclu de viață, luând în considerare factorul timp.
Cantitatea de energie termică necesară pentru producerea a 1 kg de hidrogen se calculează în funcție de reacțiile chimice ale proceselor de generare a hidrogenului. Pentru producerea hidrogenului în procesul de electroliză, calculul energiei termice necesare se efectuează în raport cu o centrală nucleară cu un reactor monobloc cu fierbere de tip Beta cu un factor de eficiență de 30%. Rezultatele calculelor sunt prezentate în tabelul 1.7.
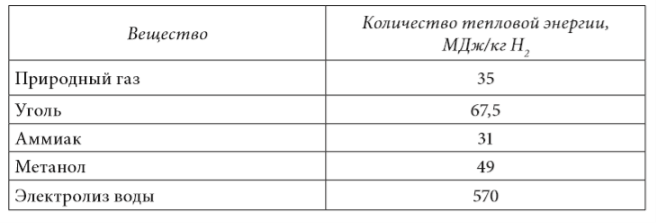
Datele prezentate în tabelul 1.7 arată că materia primă de hidrocarburi și amoniacul necesită aproximativ aceeași cantitate de energie termică pentru a produce 1 kg de hidrogen. În același timp, în procesul de electroliză, cantitatea de energie consumată este cu un ordin de mărime mai mare și depășește semnificativ (de peste 2,5 ori) căldura mai mare de ardere a hidrogenului.
Utilizarea energiei nucleare pentru producerea hidrogenului
Producția de hidrogen este caracterizată de un consum specific ridicat de energie. În procesele care utilizează combustibili fosili, energia este obținută prin arderea acestor combustibili — aproximativ jumătate din gazul utilizat este ars pentru realizarea tehnologiei PMC. Procesele de electroliză consumă în medie 50 MW de energie electrică pe tonă de hidrogen. La realizarea ciclurilor termochimice, sunt necesare temperaturi de aproximativ 1000 K, ceea ce presupune costuri materiale substanțiale pentru producerea hidrogenului și duce la o perspectivă îndepărtată de aplicare pe scară largă a hidrogenului în sectorul energetic.
Aplicarea energiei nucleare pentru producerea hidrogenului poate schimba această tendință. Tehnologia nucleară dispune de resurse practic nelimitate de energie ieftină pentru producerea hidrogenului; în plus, energia nucleară are cel mai mic impact asupra mediului în ceea ce privește producerea de electricitate, căldură și hidrogen în comparație cu utilizarea resurselor de carbon.
Folosind energia electrică produsă de energia nucleară, este posibilă, prin electroliză, separarea apei în hidrogen și oxigen. În cazul în care electroliza se realizează cu ajutorul aburului la temperatură ridicată, energia termică produsă de reactorul nuclear poate înlocui o parte din energia electrică, iar randamentul net (raportul dintre hidrogenul cu putere termică ridicată (HHV) produs și energia electrică consumată) va crește. În ciclurile termochimice de separare a apei, este posibil să se obțină toată energia de intrare din căldura produsă în reactoarele nucleare, folosind reacții chimice complexe, determinate de căldură, pentru a descompune apa în oxigen și hidrogen, și să se obțină o eficiență de ~50%.
Electroliza la temperatură joasă
Această metodă este o tehnologie comercială pe deplin dovedită care asigură în prezent 4% din producția de hidrogen în SUA. Instalațiile de electroliză sunt disponibile în comerț și utilizează trei tehnologii diferite — celule unipolare și bipolare care utilizează o soluție apoasă de hidroxid de potasiu (electroliză alcalină) și celule cu membrană de schimb protonic (electroliză PEM). În instalațiile mari, se utilizează de obicei tehnologia alcalină. Instalațiile sunt disponibile într-o varietate de capacități, de până la ~1000 kg de H2 pe zi, iar unitățile pot fi conectate în paralel pentru a crește producția.
Instalațiile de capacitate mare funcționează de obicei la o presiune apropiată de cea atmosferică; hidrogenul produs este apoi comprimat pentru a atinge presiunea din conducte (20-30 atmosfere). Sunt în curs de dezvoltare instalații de înaltă presiune care vor face inutilă comprimarea hidrogenului.
Limita de eficiență netă a sistemelor de electroliză la temperatură joasă care produc hidrogen la presiunea din conducte este de ~75%. Dacă o unitate de electroliză la temperatură joasă este conectată la un LWR care produce electricitate cu un randament termic de 32%, randamentul net al producției de hidrogen este de 24%, dar pentru un reactor avansat cu un randament termic de 48% acesta ar fi de 36%.
Pierderea de eficiență și creșterea cheltuielilor de capital prin utilizarea procesului în două etape de conversie a căldurii la temperaturi ridicate în energie electrică și apoi utilizarea energiei electrice pentru producerea hidrogenului reprezintă un aspect negativ semnificativ al electrolizei la temperatură joasă.
La costurile tipice de generare a electricității și de electroliză, costul hidrogenului produs este ridicat: 4-6 $/kg sau mai mult. Utilă pentru aplicații la scară mică, această metodă nu poate concura cu tehnologia de producere a hidrogenului din gaze naturale, unde costul tipic al hidrogenului este de 1,00-1,50 $/kg. În cazul în care sunt disponibile cantități mari de energie electrică la costuri foarte scăzute, cum ar fi în centralele hidroelectrice, electroliza la temperatură scăzută este destul de acceptabilă. Aceasta poate fi pornită și oprită rapid și ușor și poate fi utilizată pentru a produce hidrogen stocabil.
Electroliza la temperatură joasă este aplicabilă în SNP, dar numai dacă există un surplus mare de capacitate. În prezent, companiile energetice răspund cererii de bază prin utilizarea centralelor nucleare și a altor metode de producere a energiei cu costuri de exploatare reduse și acoperă vârfurile de sarcină prin adăugarea de unități alimentate cu combustibili fosili.
Acestea din urmă au costuri ridicate de combustibil și sunt închise atunci când nu sunt necesare pentru a acoperi cererea. Electroliza la temperatură joasă ar putea juca un rol în producția de hidrogen nuclear la scară largă, în cazul în care companiile energetice ar dispune de o capacitate nucleară mai mare decât cea necesară pentru a acoperi cererea de energie electrică de bază și ar putea transfera producția de energie electrică din rețea către instalațiile de electroliză în timpul perioadelor de cerere scăzută de energie electrică de bază.
Electroliza la temperatură ridicată
În această metodă, vaporii cu o temperatură de ~800 °C este separată astfel încât hidrogenul și oxigenul sunt colectate la doi electrozi (figura 1).
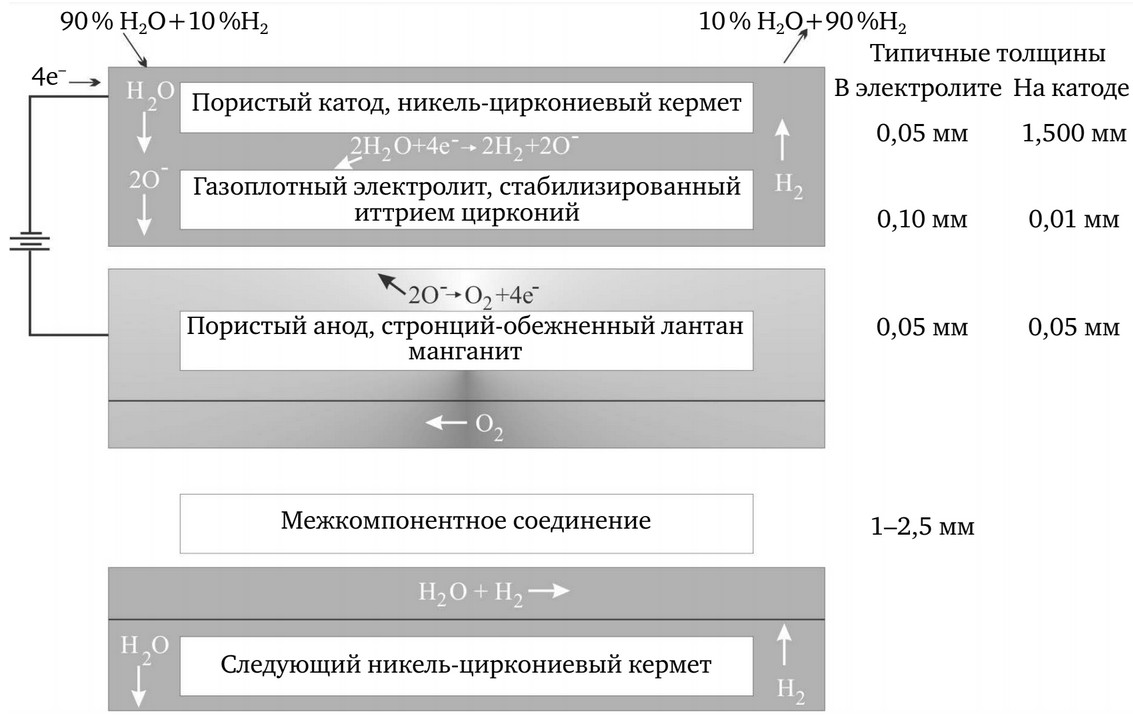
Funcționarea celulei la temperaturi ridicate reduce cantitatea de energie electrică necesară pentru producerea hidrogenului, deoarece aproximativ 30 % din energie poate fi introdusă în proces sub formă de căldură și nu de energie electrică. În plus, la temperaturi de 800-1000 °C, rezistența la mișcarea ionilor de oxigen prin electrolitul de zirconiu stabilizat cu oxid de ytriu sau de scandiu este mult redusă și toate reacțiile chimice au loc foarte rapid. În cele din urmă, eficiența producerii de electricitate de către un reactor care funcționează la temperaturi ridicate este mult mai mare (aproximativ 45%). Combinația acestor efecte poate duce la un randament complet de producție a hidrogenului de 45-50%.
Procesul de electroliză este realizat după cum urmează. Vaporii și o cantitate mică de hidrogen (pentru a menține o stare schimbătoare în catodul de dioxid de zirconiu-nichel) sunt introduse pe o parte a unei celule plate.
Vaporii difuzează până la interfața dintre electrod și electrolit, unde are loc prima reacție 2H2O + e — → 2H2 + 2О 2- . Ionii de oxigen transportă un curent electric prin electrolitul solid până la interfața dintre electrolit și anod, unde reacția 2O 2- → O2+ e — . Placa de legătură (în aval de anod în figura 1) asigură canalele de curgere pentru amestecul vapori-hidrogen care intră și iese, precum și pentru oxigenul produs în anod. Aceasta asigură, de asemenea, conexiunea electrică a celulei la celula următoare. Oxigenul trece prin anodul de manganit de lantan-stronțiu (LSM), iar amestecul vapori-hidrogen trece prin catodul de pe partea opusă a electrolitului. În cadrul testelor (octombrie 2004 și ianuarie 2005), un set experimental de zece celule a produs hidrogen sub formă de gaz (peste 60 l/h).
Idaho National Laboratory (INL), în colaborare cu Ceramatec, investighează problemele tehnice și de extindere asociate electrolizei cu oxid solid, cu abur. Rezultatele testelor cu celule au demonstrat producția eficientă de hidrogen la scară mică, cu caracteristici de funcționare apropiate de previziunile teoretice. Pe baza acestor rezultate preliminare, electroliza la temperatură ridicată este considerată o metodă viabilă de producere a hidrogenului prin utilizarea energiei nucleare.
Descompunerea termochimică a apei
Descompunerea termochimică a apei este transformarea apei în hidrogen și oxigen printr-o serie de reacții chimice determinate de căldură.
După cum se știe, descompunerea termică directă a apei în hidrogen și oxigen necesită o temperatură ridicată de 2500 oC. Cu toate acestea, apa poate fi, de asemenea, descompusă termic la o temperatură mai scăzută, de aproximativ 1000 o C, așa cum este necesar pentru procesul termochimic de producere a hidrogenului, cu randamente de până la 50%.
Spre deosebire de electroliză, energia este utilizată direct pentru a descompune compușii care conțin hidrogen. În anumite etape ale acestui tip de proces, electricitatea (electroliza, plasma) poate fi utilizată în plus față de acțiunea termică pentru desprinderea hidrogenului. Acestea se numesc cicluri termochimice hibride sau procese electro-thermo-chimice.
Temperatura mai ridicată crește viteza de reacție și reduce numărul de etape necesare pentru proces. Temperatura necesară în fiecare etapă trebuie să corespundă căldurii furnizate pentru a evita risipa de energie și materiale.
Energia termică este introdusă în ciclul termochimic prin una sau mai multe reacții chimice endotermice la temperatură ridicată. Una sau mai multe reacții exotermice la temperatură joasă sunt utilizate pentru disiparea energiei la ieșirea din ciclu. Toți reactanții, în afară de apă, sunt recuperați și reintroduși în ciclu.
Astfel, ciclurile termochimice și combinate de producere a hidrogenului constau în descompunerea în mai multe etape a apei prin diverse reacții chimice. Sunt cunoscute zeci de mii de astfel de metode, iar în fiecare an apar alte aproximativ cincizeci. În esență, ciclurile termochimice constau în legarea apei, scindarea hidrogenului și a oxigenului și regenerarea reactivilor:
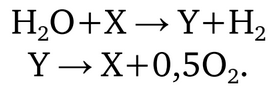
Reactivii X și Y, iar în metodele cu mai multe etape se folosesc substanțe suplimentare, determină denumirea ciclurilor: cicluri pe bază de halogenuri, pe bază de metale și oxizii acestora, pe bază de diverși compuși ai carbonului și cicluri pe bază de sulf.
În ciclurile termochimice și combinate, din punct de vedere economic și ecologic, utilizarea compușilor de arsenic, mercur, vanadiu, stronțiu, cesiu, brom, iod, chiar dacă sunt promițători din punct de vedere termodinamic, este greu de justificat. Ciclurile cele mai competitive sunt cele care utilizează reactivi ieftini și ușor disponibili: fier, sulf, oxizi de carbon, cloruri de fier.
În funcție de metodele de transfer de masă se împart în cicluri închise și deschise, în primele se consumă doar apă, căldură și electricitate în timpul reacțiilor (dacă ciclul este combinat), în cele din urmă, în plus față de cele menționate mai sus, se consumă reactivi (X, Y etc.), care sunt deșeuri industriale datorate oportunității economice: hidrogen sulfurat, dioxid de sulf, diverse sulfuri, metale neoxidate complet.
Toate metodele industriale moderne de producere a hidrogenului sunt cicluri termochimice deschise. Caracteristica lor este că energia necesară pentru descompunerea apei în hidrogen și oxigen se obține prin arderea combustibilului organic; procesul de producere a hidrogenului din apă este însoțit de reacția de legare a oxigenului de carbonul combustibilului pentru a forma dioxid de carbon (figura 2).
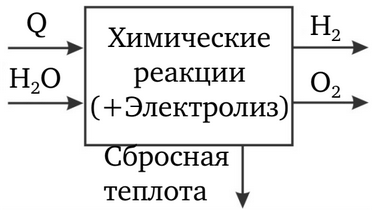
Dezavantajul unui astfel de ciclu termochimic deschis este că dioxidul de carbon este emis în mediu ca deșeu (pentru 1 t de hidrogen, 10-50 t de dioxid de carbon, în funcție de tehnologia procesului și de natura combustibilului inițial) (tabelul 1).
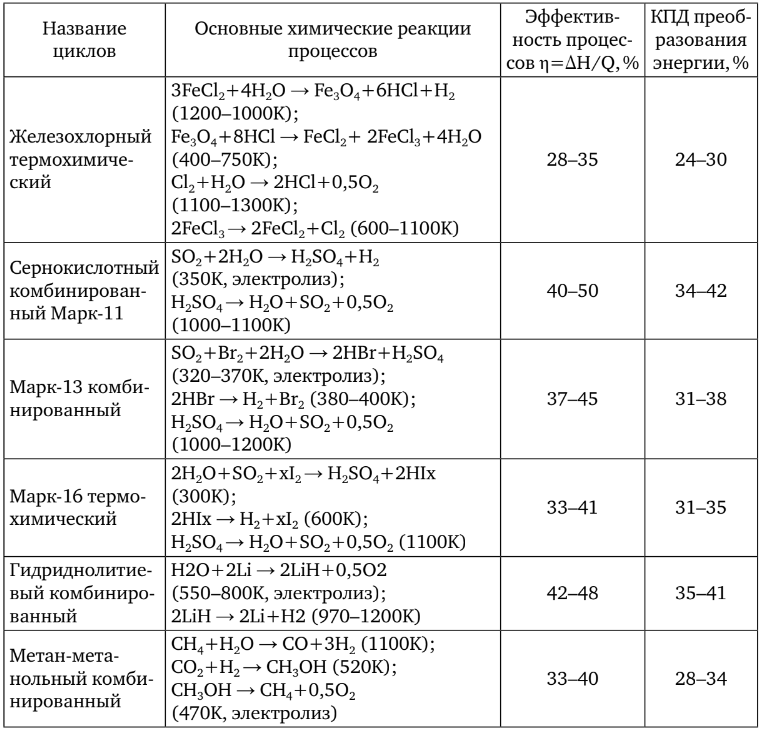
Eficiența este calculată în funcție de căldura mai mare de ardere a hidrogenului, iar eficiența în funcție de căldura mai mică de ardere.
Elementele chimice din procesul termochimic sunt utilizate la nesfârșit, cu pierderi foarte mici sau inexistente. Condițiile de bază sunt energia termică și apa. În unele procese, electricitatea este utilizată pentru electroliză în una sau mai multe etape. Elementele chimice utilizate includ diverși catalizatori, soluții organice, substanțe complexe și săruri solubile.
Ciclul sulfatului de bismut
Ciclul sulfatului de bismut, inventat de Los Alamos Science Laboratory, a fost evaluat pentru randamente mai mari de 50% la 1000 °C (1800 °F).
Procesul necesită mai puțin acid sulfuric decât alte procese. Acest lucru reduce tensiunea pentru etapa de electroliză (prima etapă prezentată mai jos). Corodarea este, de asemenea, redusă. Procesul utilizează elemente chimice solide.
În prima etapă, apa și dioxidul de sulf formează hidrogen și acid sulfuric. Apoi, acidul sulfuric este transportat la un rezervor care conține Bi2О3 + SO3. Conținutul reacționează cu acidul sulfuric pentru a produce Bi2О3-2SO3. Acest compus este uscat și încălzit la 800°C (1500°F). Acest compus se descompune apoi în Bi2O3 + SO3 și trioxid de sulf. Trioxidul de sulf este încălzit la 800°C (1500°F) și se descompune în dioxid de sulf și oxigen. Dioxidul de sulf este răcit, separat și returnat în electrolit.
Oxigenul din acest proces poate fi utilizat pentru producerea fierului și pentru aerarea corpurilor de apă. Dacă se produce mai mult oxigen decât este necesar, acesta se scurge în atmosferă.
În ceea ce privește celelalte cicluri termochimice, fiecare intră în procesul menționat mai sus, o reacție chimică separată care trebuie să aibă loc astfel încât cantitățile necesare de produse rezultate să fie disponibile pentru etapa următoare, fără pierderi.
Ciclul Westinghouse
Ciclul Westinghouse are loc la 300-375 °C (570-700 °F).
Ca și în ciclul bismutului, prima etapă implică electroliza apei pentru a produce acid sulfuric și hidrogen. Ultima reacție este o descompunere simplă a moleculei de acid sulfuric la o temperatură ridicată de 1200 °C (2190 °F). Descompunerea a 84% din reactanți poate avea loc la 1080°C (1976°F).
General Atomics (GA), Sandia National Laboratories (SNL) și Universitatea din Kentucky au analizat literatura mondială privind ciclurile termochimice de descompunere a apei. Cele mai promițătoare 25 de cicluri au fost selectate din cele 115 cicluri analizate pentru o evaluare tehnică detaliată. Examinând termodinamica chimică a acestor cicluri și evaluând diagramele tehnice preliminare, a fost selectat ciclul iod-sulf (IS) (figura 3).
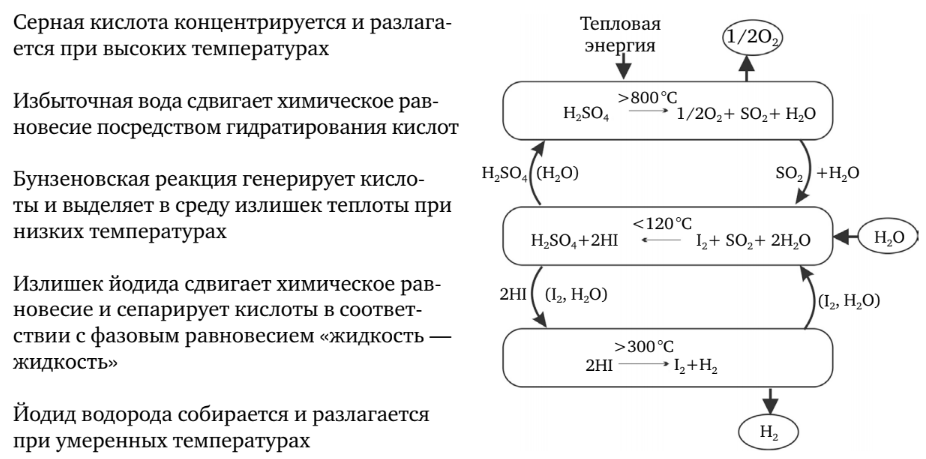
Ciclul iod-sulf
În ciclul IS, iodul și dioxidul de sulf sunt adăugate la apă, ceea ce duce la o reacție exotermică pentru a forma iodură de hidrogen și acid sulfuric. În condiții adecvate, aceste substanțe sunt nemiscibile și pot fi ușor separate. Acidul sulfuric se descompune la 850 °C, eliberând oxigen și reciclând dioxid de sulf. Iodura de hidrogen se descompune la aproximativ 350 °C, eliberând hidrogen și reciclând iodul. Rezultatul final al reacției este descompunerea apei în hidrogen și oxigen. Intrarea procesului necesită doar apă și energie termică la temperatură ridicată, în timp ce ieșirea produce hidrogen, oxigen și energie termică la temperatură scăzută.
Se produc cantități reduse de hidrogen și există dificultăți în separarea acidului sulfuric de iodura de hidrogen, dar nu există deșeuri.
Instalațiile de testare la scară de laborator pentru ciclul IS de joasă presiune au fost demonstrate cu succes la Institutul japonez pentru energie atomică. În prezent, GA, SNL și CEA-Saclay efectuează în comun pregătiri pentru testarea la scară de laborator în condiții prototipice de presiune și temperatură (figura 4).
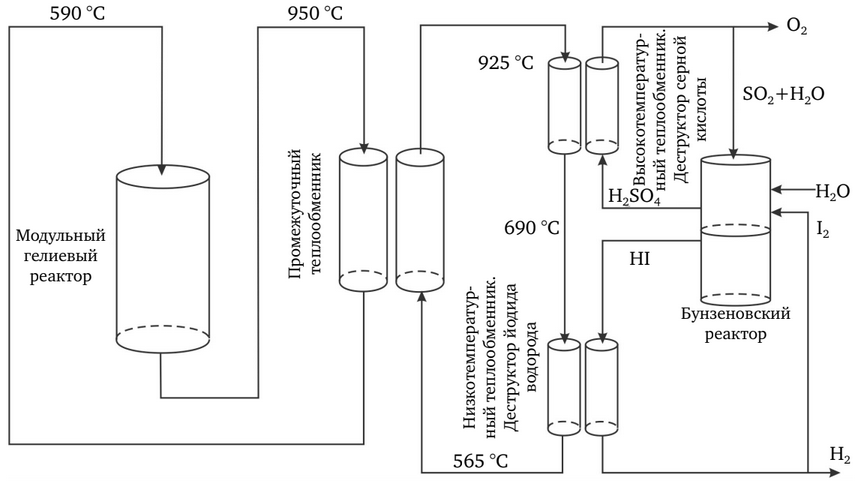
Ciclul IS necesită temperaturi ridicate, dar oferă o eficiență ridicată în conversia energiei termice în hidrogen (figura 5). Principalul avantaj este că amploarea reacțiilor chimice este determinată de volum și nu de suprafața electrozilor, ca în cazul electrolizei.
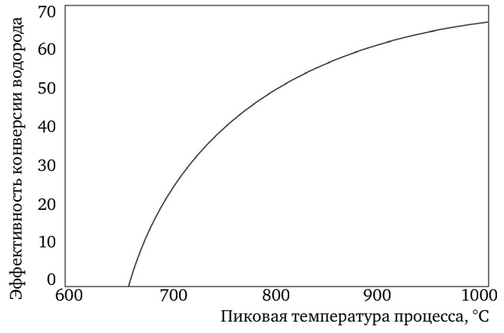
Astfel, producția de hidrogen la scară largă în energia nucleară ar trebui să permită economii substanțiale. Un studiu detaliat al proiectului indică faptul că un ciclu IS cuplat la un reactor modular cu heliu ar putea produce hidrogen la un cost de 1,50-2,00 $/kg, nu cu mult mai mult decât costul actual de producere a hidrogenului din gaze naturale.
Mai jos este prezentat un alt proces studiat la Los Alamos. Procesul nu utilizează electroliza. Principalul dezavantaj este reprezentat de temperaturile ridicate.
CdO → Cd + 1/2 O2 la peste 1500 °C
Oamenii de știință au ajuns la concluzia că cel mai promițător dintre cele patru procese este ciclul brom-sulf. O demonstrație a acestui proces a avut loc în mai 1978. A fost primul proces termochimic complet pentru producerea hidrogenului prin descompunerea apei.
Acidul sulfuric reprezintă 75 % din greutatea întregului amestec. Acidul este descompus la 90-1200°C și la o presiune scăzută de 3 atm. Oțelul este utilizat ca catalizator. Nu este nevoie de un schimbător de căldură.
În etapa a treia, bromura de hidrogen se descompune la 0,80 W. Se obține 0,1 m 3 /h de hidrogen. Cele două gaze sunt ușor de separat deoarece hidrogenul este mai ușor. Nu este necesar niciun separator. Iată specificațiile de producție pentru 18 luni în perioada 1984-1985.
- Volumul de hidrogen produs pe oră: 1000 m3/h.
- Acid sulfuric prelucrat: 43,7 kg/h.
- Presiunea de funcționare: 24,7 atm.
- Temperatura maximă de funcționare: 950 °C (1740 °F).
- Electricitate necesară: 100 kW.
- Eficiență: 30-40%.
- Cost: 1,00 $/m3 /ora.
Eficiența și costul sunt comparate cu cele ale electrolizei la temperatură ridicată a polimerului solid de 28-32%. Producția nu a prezentat instabilități, subproduse sau reacții extrinseci. Cunoștințele disponibile, tehnologia chimică și materialele comerciale sunt suficiente pentru a construi instalații pilot industriale, nefiind necesară nicio descoperire tehnică majoră… Producția termochimică de hidrogen este fezabilă.
Procesul acidului azotic
Newell Cook a dezvoltat un proces de reciclare a oxizilor de azot și a acidului, descompunând apa pentru a produce hidrogen. Oxidul de azot are un punct de fierbere scăzut, un potențial de ionizare scăzut și o stabilitate termică ridicată. Mulți acizi pot fi utilizați în locul acidului fosforic.
Acidul fosforic se descompune, eliberând hidrogen și formând fosfat de azot. Când se adaugă apă, se obține acidul și jumătate din oxidul de azot. Se eliberează căldură, NO2 este încălzit pentru a forma NO, care este reutilizat.
Oxidul nitric se descompune într-un ion pozitiv (NO+) și un electron liber (e — ). Acest proces de dezintegrare este mai eficient decât electroliza. Energia necesară este de 58,2 W la 20°C (68°F) și 1 atm. Acest proces produce cantități mici de hidrogen, dar este mai ușor de realizat decât alte cicluri chimice.
Ciclul cupru-clor
Interesul pentru procesele termochimice, care a apărut în timpul crizei energetice din anii 1970 și a dispărut odată cu aceasta, a fost reluat recent, deoarece prețurile combustibililor fosili au atins niveluri record. Departamentul american al Energiei (DoE) revizuiește unele dintre cele mai promițătoare concepte inițiale, precum și concepte noi bazate pe progresele tehnice din ultimii 30 de ani. Programul de cercetare al DoE se orientează către procese termochimice alternative care au potențial de performanță ridicată (eficiență ridicată, cerințe de temperatură scăzute sau complexitate și corozivitate reduse).
Ciclurile termochimice alternative pot funcționa la temperaturi mai scăzute (aproximativ 550 °C) decât ciclurile cu sulf la temperaturi ridicate, care necesită energie termică la temperaturi de peste 825 °C. Ciclurile care funcționează la temperaturi mai scăzute au două avantaje: cerințe materiale mai reduse și o mai mare flexibilitate în ceea ce privește sursele de energie termică.
Următoarele reactoare sunt adecvate pentru cuplarea la cicluri cu temperatură joasă: reactoarele cu apă supercritică, cum ar fi Candu-Mark 2, un reactor rapid avansat răcit cu sodiu și un reactor cu gaz la temperatură înaltă (HTGR), acesta din urmă putând fi utilizat pentru a produce electricitate la randament ridicat.
Argonne National Laboratory investighează potențialul unui ciclu Cu-Cl la temperatură joasă care constă în patru reacții principale:
Hidrogenul este produs la 425 °C, iar oxigenul la 530 °C. Acestea sunt cele mai ridicate temperaturi din ciclu. În plus, aceste reacții implică generarea de gaz și solid sau lichid. Ele pot fi finalizate prin simpla eliberare a gazului, minimizând astfel fluxurile de reciclare. Datorită lipsei reacțiilor concurente, acestea sunt ideale pentru un proces ciclic. Reacțiile intermediare, care ridică probleme majore, sunt în prezent explorate. Combinația dintre substanțele chimice relativ ieftine și eficiența netă ridicată de 49% (HHV) este atractivă. Deși această eficiență este ceva mai scăzută decât în cazul ciclurilor cu sulf, chimia promițătoare ne face să recunoaștem că ciclul Cu-Cl are un potențial real. DoE sponsorizează lucrări de evaluare a altor cicluri insuficient studiate pentru a ne asigura că nu pierdem opțiuni potențial importante.
Cicluri hibride: ciclul HyS
Ciclurile de degradare a apei care implică cel puțin o etapă de reacție electrochimică sunt clasificate drept cicluri termochimice hibride. Cel mai cunoscut și bine studiat dintre acestea este ciclul hibrid al sulfului, cunoscut și sub denumirea de ciclul HyS, ciclul Westinghouse al sulfului, ciclul Ispra Mark II sau ciclul GA 22 (figura 6). Toate ciclurile pur termochimice (tip IS) necesită cel puțin trei etape de reacție separate. Ciclurile hibride pot avea doar două etape. Ciclul HyS are următoarele etape: H2SО4 => SO2 + Н2O + 1/2 O2 și 2H2O + SO2 => H2SО4 + Н2. Ambele procese sunt termochimice; primul are loc la 800-900 °C, iar al doilea la 100-120 °C.
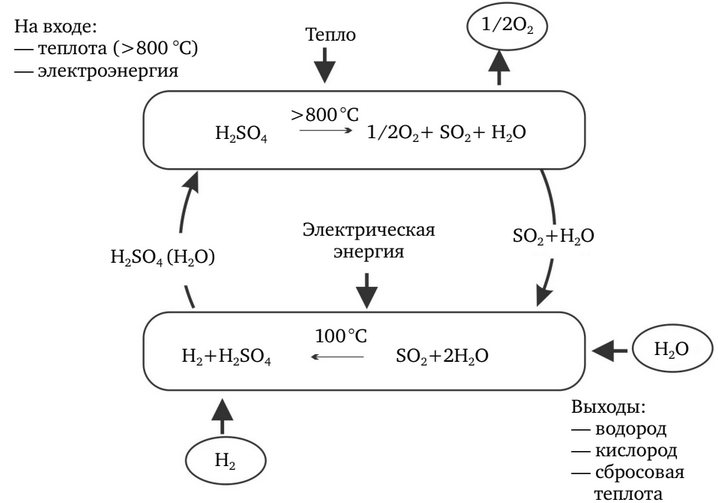
Prezența SO2 la anodul electrolizorului reduce puternic potențialul reversibil al celulei, care este necesar pentru scindarea moleculelor de apă prin electroliză. Deoarece electroliza directă a apei are un potențial de celulă reversibil de 1,23 V la 25 °C, potențialul teoretic pentru electroliză pe un anod depolarizat de SC>2 ar fi de numai 0,17 V pe celulă. În practică, SO2-practice ar trebui să consume de patru ori mai puțină energie electrică decât electrolizoarele convenționale.
În combinație cu descompunerea endotermică a H2SО4Cerințele nete de energie termică pentru ciclul HyS sunt semnificativ mai mici decât pentru electroliza directă a apei. Provocarea constă în proiectarea unui proces care să maximizeze avantajul eficienței termice, reducând în același timp la minimum complexitatea și cheltuielile de capital.
Lucrările recente de la Savannah River National Laboratory (SRNL) au condus la îmbunătățirea procesului în ciclul HyS. A fost analizată proiectarea procesului unui sistem HyS cuplat la un reactor nuclear răcit cu heliu. Eficiența termică netă calculată a sistemului a fost de 48,8 % cu o temperatură de intrare în proces de 900°C.
Dezvoltarea unui electrolizor depolarizat de SO2-depolarizat care să îndeplinească parametrii de funcționare specificați, să aibă o durată lungă de funcționare și să fie rentabil este principalul obiectiv al cercetărilor în curs. SRNL dezvoltă un electrolizor bazat pe electroliza REM. Condițiile unice ale electrolizei SO2 cum ar fi necesitatea de a face față acidului sulfuric și SO2fac o astfel de dezvoltare o sarcină dificilă. Dezvoltarea unui electrolizor cu costuri reduse este un factor-cheie în obținerea unui ciclu HyS rentabil.
Analizele economice preliminare, bazate pe o extrapolare rezonabilă a costurilor previzionate ale electrolizorului PEM, indică faptul că un ciclu HyS în combinație cu un reactor cu gaz răcit cu heliu ar putea produce hidrogen la un cost de ~1,60 USD/kg, care este aproximativ același cu costul procesului IS. Veniturile suplimentare din vânzarea produsului secundar (oxigen) ar putea reduce costurile.
Problemele tehnice includ optimizarea condițiilor de funcționare (temperatură, presiune, concentrație de acid), materialele de construcție, proiectarea celulelor (inclusiv selectarea membranei și încărcarea electrocatalizatorului), precum și durabilitatea și performanța.
Alte aspecte tehnice sunt legate de secțiunea de descompunere a acidului sulfuric și de sistemul de separare a SO2/О2. Următorul pas este demonstrarea unui ciclu HyS complet în buclă închis, inclusiv electrolizorul și secțiunile de descompunere a acidului.
Costuri
Elementele chimice din procesul termochimic sunt utilizate în mod repetat, cu pierderi foarte mici sau inexistente. Condițiile de bază sunt energia termică și apa. În unele procese, electricitatea este utilizată pentru electroliză în una sau mai multe etape. Elementele chimice utilizate includ diverși catalizatori, soluții organice, substanțe complexe și săruri solubile.
Pentru a compara procesele alternative, trebuie să luăm în considerare costurile economice. Costul electrolizei la temperaturi înalte cu electroliți polimerici solizi este comparabil cu costul celor mai bune cicluri termochimice. Gazeificarea cărbunelui rămâne, totuși, cea mai ieftină sursă de hidrogen. Trecerea la electroliză sau la cicluri termochimice este un proces destul de lung și costisitor.
Tabelul 2 rezumă costurile comparative ale diferitelor metode comerciale și experimentale de producere a hidrogenului.
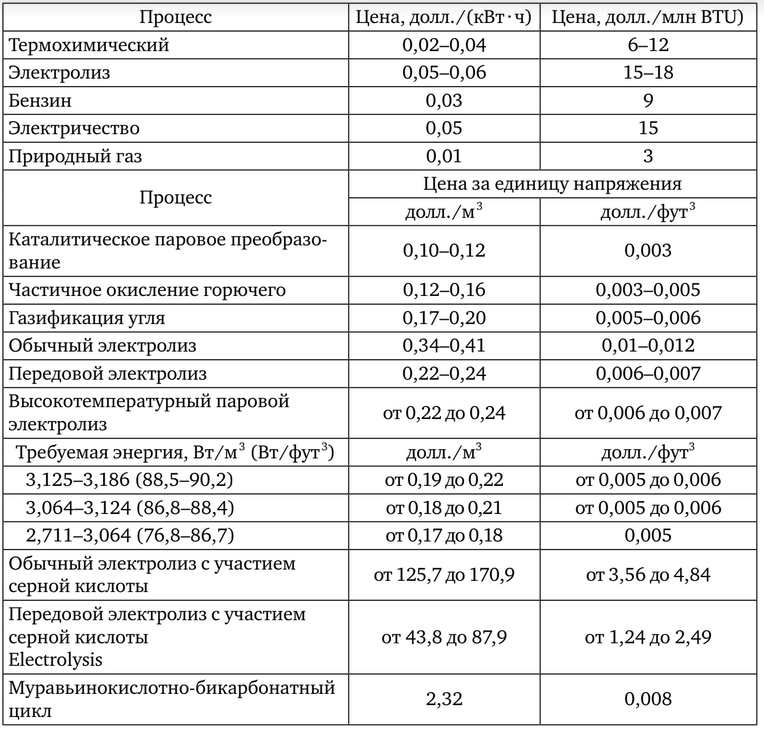
Au fost studiate mai mult de 1 000 de cicluri termochimice posibile care utilizează materiale reciclabile. Toate materialele au fost reciclate în procesul care implică hidrocarburi. Singurele materiale pentru orice ciclu termochimic au fost apa, temperatura ridicată și electricitatea. Oamenii de știință au ajuns la concluzia că cel mai promițător este ciclul bromosulfului.
În ceea ce privește costurile acestor procese termochimice, observațiile lui L.P. Bicelli sunt pesimiste. „Din cauza numeroaselor probleme, este dificil de prezis dacă unul dintre aceste procese de producere a hidrogenului, care sunt extrem de complexe din punct de vedere tehnic, va fi vreodată utilizat comercial.”