Metodele chimice de extracție a manganului din minereuri sărace, concentrate de calitate inferioară, nămoluri de îmbogățire, nămoluri metalurgice, subproduse ale industriilor conexe sunt foarte diverse și nu au o clasificare strictă. Cu toate acestea, compoziția reactivului chimic utilizat pentru levigarea materiilor prime care conțin mangan ar trebui să fie recunoscută ca fiind cea mai comună caracteristică. Clasificarea se poate baza pe tipul de mineral care conține mangan, deoarece fiecare mineral din grupa manganului interacționează în mod propriu cu acest reactiv chimic sau cu reactivul chimic respectiv.
Indiferent de aceste caracteristici, atunci când se iau în considerare metodele chimice de îmbogățire (extracția manganului), trebuie avut în vedere faptul că, practic, fiecare schemă tehnologică de îmbogățire chimică are următoarele etape:
- șlefuirea și măcinarea materiilor prime până la grade care asigură vitezele de proces necesare;
- levigarea materiilor prime cu transferul manganului în soluție;
- purificarea soluției de impuritățile dăunătoare (în principal fosfor) prin tratarea soluției cu un reactiv chimic, urmată de filtrare;
- precipitarea manganului din soluția purificată sub formă de compuși prin acțiunea asupra soluției cu un reactiv chimic sau modificarea concentrației soluției și separarea compușilor de mangan prin evaporarea soluției.
Atât în URSS, cât și în SUA s-au efectuat cercetări privind levigarea minereurilor sărace în mangan prin metode chimice și hidrometalurgice. Institutul de Chimie din Tbilisi al Academiei de Științe din Georgia a efectuat o serie de lucrări de laborator și de calcul privind hidrometalurgia manganului, precum și îmbogățirea chimică a nămolurilor de minereu Chiatura. În 1942, în SUA au fost construite instalații pentru îmbogățirea minereurilor sărace, minereurile de mangan din Nevada și Minnesota conținând 12-15 % Mn. În Nevada (Las Vegas) a fost construită o uzină cu o capacitate anuală de 110 mii tone de concentrat de 60 %. Minereul (psilomelan) a fost levigat cu acid sulfuric, soluția a fost filtrată, purificată de fier și fosfor, iar filtratul a fost evaporat cu ajutorul unui sistem de evaporare în vid cu mai multe carene. Din cauza lipsei de informații disponibile și fiabile, soarta acestui obiect, precum și a altor obiecte similare, este necunoscută. Ar trebui să se presupună că levigatul chimic al minereurilor de mangan nu a fost aplicat industrial.
Sally A. notează că metodele chimice de levigare a minereurilor și zgurilor de calitate inferioară au fost utilizate și în Germania în perioada 1939-1945, în SUA au fost construite instalații pilot (nu complexe industriale mari, după cum au remarcat Y. V. Klimenko și A. P. Kvaskov) pentru a studia unele dintre aceste metode. Ar trebui să se presupună că evoluțiile din anii războiului în diferite țări au avut aceeași soartă ca una dintre primele metode de îmbogățire chimică a minereurilor de mangan, propusă de Ridman (Anglia) în 1862. Esența acestei metode constă în faptul că un amestec de minereu, acid sulfuric și sulfat de sodiu este uscat, topit, apoi i se adaugă var și clorură de sodiu (sau bauxită), ars și levigat cu apă fierbinte. După purificarea nichelului și a fierului din soluție, aceasta se evaporă până la cristalizarea sulfatului de sodiu. Licoarea-mamă se evaporă până la uscare, reziduul se amestecă cu cărbune și se calcinează într-un cuptor cu mufă. Au urmat brevetele Herren — Schmidt și Kostebl (obținerea sărurilor de mangan din acid sulfuric), Ridman (1884) (clorurile de mangan sunt presărate pe plăci fierbinți în prezența aerului pentru a obține oxid de mangan și acid clorhidric), Staaden (1886) (tratarea minereului de mangan cu gaz sulfuric pentru a obține sulfură de mangan, iar aceasta din urmă, prin reacție de schimb cu CaCl2 este transformat în MnCl2). A urmat apoi un grup de brevete ale autorilor: Devi (1894) (tratarea MnO2 cu soluție de sulfură ferică), Chapman (arderea carbonatului de mangan cu săruri de clorură), Dett și Dett (minereul oxidat amestecat cu alcalină caustică este ars la 600-700 °C în cuptoare în atmosferă de aer), Leaver (1918) (dizolvarea rapidă a diferiților oxizi de mangan în acid sulfuric fierbinte, a cărui soluție este obținută prin trecerea gazului fierbinte al cuptorului (2-6 % SiO2) în contracurent cu pasta), Kaplan (tratarea dioxidului de carbon de mangan cu aer conținând vapori de HNO la 300 °C), baia lui Kaplan-À.3 la 300 °C), van-Arsdal (pulpa de minereu de oxid de mangan este suflată cu gaz sulfuric pentru a forma o soluție de MnSO4 și MnS2O6). În următorii 20-30 de ani ai secolului XX au apărut o serie de brevete care aveau ca obiect procedeele (modalitățile) de levigare a minereurilor în vederea obținerii de soluții de mangan pentru producerea electrolitică ulterioară a manganului metalic: procedeul lui Westling (1924), Bradley (dizolvarea MnO în soluții apoase de amoniu sulfuric, precedată de prăjirea reductivă a minereului), Bradley (levigarea MnO în soluții apoase de amoniu sulfuric, precedată de prăjirea reductivă a minereului). ) (obținerea sulfurii de mangan), Bradley (dizolvarea MnO în soluții apoase de sulfură de amoniu, precedată de prăjirea reductivă a minereului), Sweet (1929) (metoda amoniacală de levigare a minereurilor carbonate) etc. În anii ’30, situația era de așa natură încât noile brevete, conform concluziei lui Y. V. Klimenko și A. P. Kvaskov, erau suficient de monotone și deseori se deosebeau între ele doar prin detalii nesemnificative.
În URSS, în anii ’30, lucrările de creare a schemelor tehnologice de extracție a manganului din materii prime sărace au fost efectuate, de asemenea, în legătură cu diferite varietăți mineralogice de minereuri sărace și nămoluri de îmbogățire. În 1935, A. Kobakhidze și T. Ambokadze (TCI al Academiei de Științe a RSSM), pe baza metodei Bradley, au elaborat un proces ale cărui etape principale sunt reducerea oxizilor de mangan la MnO cu un amestec gazos de CO + H2(la > 400 °C) sau carbon solid (700 °C); răcirea rapidă a produsului redus și depozitarea acestuia fără acces la aer; levigarea produsului de prăjire în soluții apoase de sulfat de amoniu (sau soluții de alți reactivi chimici care leagă MnO). K. A. Krivoruchko și P. M. Kanibolotsky (DNIGRI) (1935) au studiat lixivierea nămolului de preparare a minereului Nikopol cu sulfură de amoniu. Lucrările privind levigarea minereurilor sărace în mangan și a nămolurilor în acești ani au fost efectuate și la Uralmekhanobra (A. V. Kirsanov, Y. V. Kvaskov, 1934), la Institutul de Tehnologie Chimică din Moscova (K. M. Saldadze, 1938), la Institutul de Chimie Aplicată din Rostov (T. M. Zolotikh, 1935), la GIPKh (Ya. E. Seferovich, 1940) și altele. În perioada postbelică, până la mijlocul anilor ’60, industria manganului din Ucraina nu a manifestat interes pentru metodele chimice de îmbogățire a nămolului din instalațiile de îmbogățire, deoarece minele și carierele distruse în timpul războiului au fost refăcute și au fost introduse noi capacități atât pentru minerit, cât și pentru îmbogățirea minereului. Exploatarea extensivă a rezervelor de minereu de oxid de mangan de înaltă calitate a fost însoțită de formarea unei cantități uriașe de nămol de îmbogățire care conținea 10-14 % Mn, iar în iazurile vechi 17-20 % Mn. De-a lungul anilor de exploatare a zăcământului de minereu de mangan de la Nikopol, în depozitele de nămol s-au acumulat peste 100 de milioane de tone de nămol de exploatare care conțineau nu mai puțin de 10 milioane de tone de mangan. Construcția și exploatarea instalațiilor de stocare a nămolului sunt asociate cu costuri relativ ridicate. Pe măsură ce nămolul se acumulează cu
Interesul crescut pentru căutarea de noi metode chimice și hidrometalurgice de îmbogățire a minereurilor și nămolurilor sărace în ultimul deceniu este remarcat și în străinătate în legătură cu soluționarea problemei economisirii resurselor. În acest sens, sunt analizate în continuare noile scheme și procedee tehnologice brevetate de extracție chimică a manganului din materii prime care conțin mangan.
Conținut
Procedee cu acid sulfuric și acid sulfuric
Acest grup de procese este analizat în lucrările lui Yu. V. Klimenko și A. P. Kvaskov, A. Sally, precum și într-o serie de compilații științifice și publicații individuale. Domeniul de aplicare al proceselor de acid sulfuric și sulfuric, precum și al SO2este determinat de natura mineralelor purtătoare de mangan din minereuri, nămoluri și zgură. Dacă manganul se prezintă sub formă de oxid MnO2 (IV), acesta poate fi transferat relativ ușor în soluție cu ajutorul reactivilor sulfurați specificați. În cazul mineralelor de mangan de tip carbonat, minereul (zguri) trebuie supus în prealabil unei calcinări pentru a transforma compușii carbonat în compuși oxid. Potrivit lui A. Sully, procedeele cu sulf nu sunt aplicabile minereurilor în care manganul este prezent sub formă de silicat. Leaver a studiat procesul de extracție a manganului din minereu prin tratarea acestuia cu acid sulfuric fierbinte, obținut prin trecerea SO2prin concentratul de minereu. O variantă a acestui proces care utilizează SO2 a fost studiată amănunțit în SUA, unde, în 1943, compania „Manganese Ore Io” a pus în funcțiune o instalație în statul Nevada pentru prelucrarea a 1000 tone/zi de minereu cu un conținut de 20% Mn. Din cauza dificultăților mari, acest proces, precum și multe altele, nu a fost aplicat industrial. Au fost constatate o serie de dezavantaje ale procedeului.
- Formarea de politianați (ditionați) de mangan prin reacție: 2H2SO3 + MnO2 = MnS2O6 + 2H2O, care complică procesul.
- Formarea sării de acid sulfuric între sulful elementar și H2SO3 : S + H2SO3 ↔ S2O3 2- + 2H + .
- Necesitatea de a menține pH-ul mediului sub 3,5, ceea ce reduce dezvoltarea proceselor de mai sus.
- Formarea de sulfat de calciu, care duce la creșterea excesivă a aparatului.
- Necesitatea evaporării soluției și obținerea sulfatului de mangan și arderea acestuia la 800-1000 °C.
Unul dintre dezavantajele utilizării gazului sulfuric și a acidului sulfuric pentru extracția manganului din minereuri și nămoluri este formarea în faza lichidă a compușilor derivați MnSO2, Mn (HSO3)2, MnS2O6etc., care complică prelucrarea ulterioară. Se propune o metodă de prelucrare a minereurilor care conțin diferențe minerale de carbonat și silicat utilizând un reactiv chimic mai puternic, acidul sulfuric, în combinație cu acidul sulfuric, care accelerează (de 1,5-2 ori) procesul de levigare a minereurilor. Prelucrarea materiilor prime care conțin diferite forme de mangan, trecerea manganului în soluție sub formă de MnSO4 are loc prin reacții chimice:
În experimente comparative, minereul de mangan oxid-carbonat (23,5 % Mn; 8,2 % Mn 4+ ; 15,3 % Mn 2+ ; 5,8 % CaO ; 29,5 % SiO2) a fost levigat cu gaz sulfuric pur (în suspensie apoasă), precum și cu un amestec de gaz sulfuric și acid sulfuric. Eficiența mai mare a levigării minereului cu amestecul de SO2 + H2SO4. Astfel, gradul de extracție a manganului în soluție la levigarea minereului cu SO2 timp de 30 min a fost de ~30 %, iar în cazul aplicării amestecului de SO2 + H2SO490 %. Această metodă elimină necesitatea arderii prealabile a materiilor prime care conțin mangan. Nu este nevoie de consum de reactivi și de operațiuni suplimentare de purificare a soluției de impurități, deoarece purificarea soluției se realizează prin încălzirea suspensiei până la descompunerea completă a acidului sulfuric în exces și eliminarea gazului sulfuric. „Autocurățarea” fazei lichide, după cum au remarcat dezvoltatorii, are loc dacă acidul sulfuric este luat într-o cantitate echivalentă în raport cu componentele solubile în acid ale minereului. În timpul levigării materiei prime, H2SO4 este consumat complet pentru reacții, iar în suspensie rămâne doar un exces de acid sulfuric.
Dacă o astfel de suspensie este încălzită la 90-100 °C, H2SO3 se descompune și este eliminat, iar faza lichidă fără consum de reactivi alcalini are pH 3,5-3,8. Datorită creșterii pH-ului mediului, are loc precipitarea fosforului, fierului, compușilor arsenicului și a altor impurități nedorite. Procesul trebuie efectuat fără acces la aer (la un potențial oxidant scăzut al fazei gazoase), deoarece în prezența O2 (diluare a SO2 aer) în procesul de levigare la acțiunea catalitică a compușilor de mangan, oxidarea parțială a SO3 2+ în SO4 2+ în conformitate cu schema
Oxidarea ionului SO3 2- + 0,5О2 → SO4 2- cu calcule echilibrate permite reducerea consumului de H2SO4și creșterea eficienței economice a procesului. Prelucrarea soluției obținute de MnSO4 poate fi efectuată prin metode cunoscute: evaporare, precipitare (NH4)2CO3și altele. Concentratul obținut după calcinare la 600-700 °C conținea 65-67 % Mn, 0,002-0,023 % P, 0,001 — 0,14 % S. Datele de levigare a nămolului de preparare a minereurilor oxidice (15,5 % Mn, 13,4 % Mn 4+ , 2,1 % Mn 2+ , 49,8 % SiO2, 2,9 % CaO, 3,8 % Al2O3) cu un amestec de SO2 + H2SO4. Gradul ridicat de recuperare a manganului a fost confirmat ca și în cazul levigării minereului de mangan oxid-carbonat.
Lixivierea minereului cu soluții de gravare
А. Sully a descris etapele de bază ale levigării minereurilor de mangan folosind acidul sulfuric produs prin decaparea produselor metalice din oțel. De obicei, soluțiile de decapare conțin până la 10 % H2SO4 și 10-20 % FeSO4. Tratarea minereului fin măcinat cu soluție de decapare (5 % H2SO4 și 15 % FeSO4) în condiții de laborator a asigurat o extracție a manganului de 95 %. Cele mai bune rezultate au fost obținute atunci când suspensia a fost tratată cu gaz conținând SO2. În ciuda ratei ridicate de recuperare, soluțiile de decapare sunt de obicei situate la o distanță mare de sursele de materii prime de mangan, ceea ce este asociat cu costuri ridicate de transport. În ciuda acestui fapt, diferite țări continuă să dezvolte procese de levigare pentru minereurile de mangan folosind soluții acide care conțin FeSO .4. În acest caz, Fe S O4sunt utilizate ca agent reducător Fe 2+ + 4Mn 4+ → Fe 3+ + Mn 2+ și ca component care conține sulfat.
Autorii au studiat levigarea minereului de mangan din Orissa (India) cu soluții sintetice care modelează soluții de gravură. La un debit stoechiometric de FeSO4 și T : L = 1 : 10, la o temperatură de 90 °C timp de 60 min, a fost extras 90 % Mn. Se observă că pulpa obținută este filtrată foarte slab. La adăugarea a 147 g/l H2SO4 filtrarea se îmbunătățește, dar de trei-patru ori mai mult fier trece în soluție. La tratarea minereului, redus anterior cu cărbune la 750 °C timp de 1 h, soluția sintetică de decapare conține 170-200 g/l FeSO4 și 92 g/l H2SO4extracția manganului a crescut până la 99 %.
În Franța, se propune o metodă de extracție a manganului, diferită prin faptul că ameliorează problema tratării apelor reziduale care conțin FeSO4Ele sunt utilizate în tratarea materialului sursă, transformând FeSO conținut în Fe (OH).4 în Fe (OH)2. Minereul de mangan zdrobit este amestecat cu soluție de FeSO încălzită la 90 ° C4 până la formarea unui precipitat care conține Fe (OH)2și soluție de MnSO4. Apoi soluția este evaporată la >165 °C pentru a obține cristale de MnSO4 cristale cu calcinarea lor ulterioară la ∼1000 °C.
În evoluțiile discutate mai sus, atenția principală a fost concentrată pe optimizarea parametrilor de levigare a minereurilor și aliajelor de mangan, asigurând cea mai completă extracție a manganului în soluție. În același timp, o sarcină importantă este de a determina parametrii procesului de precipitare a manganului din soluții de acid sulfuric pentru a obține precipitați cu compoziții date. Condițiile de precipitare a manganului din soluții de acid sulfuric în procesul de oxidare indusă cu obținerea MnO2. Cinetica precipitării manganului sub formă de MnO2 a fost evaluată prin modificarea concentrației de ioni Mn 2+ în soluție în prezența oxigenului molecular și a Na2SO3. Acest din urmă compus a furnizat o presiune parțială de SO2 peste soluție 0,1-2,0 kPa la pH 4-6 și temperatura camerei. S-a constatat că, la o concentrație inițială de ioni Mn 2+ de 5,2 g/l, cel mai bun grad de precipitare a fost obținut la pH 5 (soluția a reținut ~ 2 g/l Mn 2+ ). În cazul pH < 5 имеет место растворение осажденного MnO2și la pH > 5, împreună cu MnO2 Mn2O3. Influența presiunii SO2 asupra vitezei și gradului de precipitare a Mn 2+ este legată de reacția totală
în raport cu care SO2 joacă rolul unui catalizator. Consumul de SO2pare să se producă prin reacții:
Autorii au prezentat rezultatele extracției selective a nichelului, cobaltului, cuprului din noduli (0,56 % Ni, 0,12 % Co, 0,34 % Cu, 13 % Mn și 10,5 % Fe) în soluție prin levigarea lor în soluție FeSO.4 în prezența amoniacului. Procesul este descris de următoarele reacții:
Cercetătorii japonezi au dezvoltat o metodă cu acid sulfuric pentru extracția manganului din zgura de producție a ferromanganului. Zgura era compusă din 28 % Mn, 23,4 % SiO2, 16 % CaO, 9,6 % Al2O3 este dizolvată în H2SO4. Soluția de sulfat de mangan obținută se neutralizează la pH 6,0-8,5. După oxidarea soluției, se precipită hidroxizi de fier și alte metale grele. Apoi se cristalizează CaSO4 și MnSO4. Cristalele de MnSO4 sunt spălate, dizolvate în apă și trimise la electroliză pentru obținerea manganului metalic.
Lucrarea rezumă rezultatele extracției manganului din zgură săracă în mangan (16 % MnO), de obicei un produs rezidual al producției de ferromangan. În aceste experimente, cel mai ridicat grad de extracție a manganului (90 %) a fost obținut la parametrii de levigare: L : T = 5 : 1, τ = 30 min, viteza de agitare 300 min-1 și un exces de 5,5 ori de H2SO4. În cazul în care cantitatea stoechiometrică de H2SO4recuperarea a fost de numai 28 %. Se atrage atenția asupra necesității unei măcinări mai fine a zgurii; la 100 % din cantitatea de clasă din< 36 до >Recuperarea manganului la ochiuri de 52 de ochiuri a fost de 60 %, iar la un conținut de 100 % din clasa de ochiuri de 200 de ochiuri, recuperarea a atins 92 %. Scoriile reziduale de silicomangan și, într-o mai mică măsură, de ferromangan, conțin, alături de forma oxidică, până la 5-7 % mangan redus sub formă de particule încâlcite de corole de silicomangan (ferromangan); prin urmare, extracția chimică a manganului din forma oxidică ar trebui precedată de metode fizice de captare (în stare lichidă a zgurii) și separare a acestui mangan redus din zgura granulată. Separarea cu aer a zgurii de silicomangan a fost introdusă la NZPF și ZZPF pentru a obține un produs — concentrat metalic format din particule de silicomangan până la 60-70 % și partea aderentă a zgurii (până la 30-40 %).
Concentratul metalic, ca parte a încărcăturii principale, este topit în cuptoare de feroaliaje, dar poate fi utilizat și pentru deoxidarea și alierea oțelului. Metoda de extracție a corolitelor din zgura reziduală prin metoda hidrodepunerii utilizată în uzinele de îmbogățire a fost dezvoltată și comercializată. Cu toate acestea, o parte din corolitele din aliaje, care nu sunt extrase prin această metodă, se pierd iremediabil cu zgura, care este utilizată în prezent în industria construcțiilor și în construcția de drumuri. Acest lucru este valabil în primul rând pentru zgura de silicomangan, deoarece greutățile specifice ale aliajului și ale zgurii diferă cu o valoare relativ mică din cauza conținutului ridicat de siliciu din aliaj (17-20 %). În plus, zgura acidă de silicomangan (47-49 % SiO2, 12-15 % MnO) udă bine aliajul, ceea ce face dificilă separarea metalului de zgură în procesul de producție, granulare și separare (stripping). În acest sens, este interesantă experiența companiei Chromaso, care a finalizat construcția unui atelier de îmbogățire a șlamurilor grele la uzina Beauharnois (provincia Quebec) pentru producția de ferrosiliciu. Instalația este concepută pentru recuperarea corolarilor de aliaj din zgura de silicomangan.
Procesul ditionatului
Esența procesului constă în levigarea minereului de mangan sărac cu un exces de soluție de ditionat, prin suspensia căruia se trece un gaz care conține SiO.2. Procedeul descris de A. Sully poate fi descris prin reacții:
Sulfatul format MnSO4 format este precipitat sub formă de CaSO4 prin interacțiune cu ditionatul de calciu conform reacției
Soluția filtrată este tratată cu Ca (OH)2 pentru precipitarea manganului și regenerarea ditionatului de calciu:
Prăjirea Mn (OH)2la 800-900 °С conduce la obținerea unui concentrat metalurgic cu un conținut ridicat de mangan, un conținut relativ scăzut de fosfor (0,02-0,03 %), dar, în același timp, cantitatea de sulf ajunge la 2-3 %.
La Manganetsky GOK a fost construită o instalație pilot pentru extracția manganului prin procedeul ditionatului din nămolul de îmbogățire, utilizând tehnologia dezvoltată de Institutul „Mekhanobrcherm(t)” (Krivoy Rog). Instalația pilot include următoarele instalații:
- clădire de îmbogățire chimică cu un departament de deshidratare a nămolului echipat cu îngroșătoare cu diametrul de 15 m, centrifuge de tip NOGSH-11200, filtre carusel K-50 și alte echipamente;
- departamentul de îmbogățire chimică cu instalarea aparatelor de preparare, levigare, neutralizare a pulpei (suspensie), precipitare a concentratului de mangan;
- secție de uscare și brichetare a concentratului de mangan dotată cu uscătoare cu role, presă de brichetat
- secția de preparare a soluției de poliacrilamidă;
- departamentul de ardere a sulfului, care găzduiește, de asemenea, un cazan de recuperare cu tratare chimică a apei și un depozit de stocare a sulfului
- o instalație de stingere a varului pentru prepararea laptelui de var;
- o stație de pompare pentru alimentarea cu apă de reciclare cu grad de clasificare în șase secțiuni.
Dioxidul de sulf este produs prin arderea sulfului într-un reactor. Tratarea suspensiei de nămol + soluție de ditionat de calciu cu dioxid de sulf se realizează în reactoare de tip DHTI, care asigură o viteză mare a reacțiilor chimice, dar reactoarele de acest tip se supraaglomerează rapid din cauza depunerilor de sulfat de calciu. Concentratul obținut în ordinea experimentală are o compoziție de 52-56 % Mn; 0,005-0,032 % P; 1,6-3,23 % SiO2; 2,0-3,5 % S.
Autorii lucrării au efectuat experimente privind utilizarea concentratului de ditionat sub formă de brichete pentru topirea manganului metalic prin procedeul silicotermic. Brichetele din concentrat de ditionat aveau următoarea compoziție: 47-52 % Mn; 2,5-4,0 % SiO2; 1-3 % Fe; 2,4-3,5 % S și 0,012-0,030 % P și corespundeau normelor din TU 14-9-299-85. Topirea a fost efectuată cu înlocuirea unei părți din zgura de mangan cu conținut scăzut de fosfor cu brichete din concentrat de ditionat. S-a confirmat că utilizarea de materii prime de mangan cu o cantitate mai mică de impurități însoțitoare (SiO2, Al2O3) crește extracția manganului și îmbunătățește întregul complex de indicatori tehnici și economici.
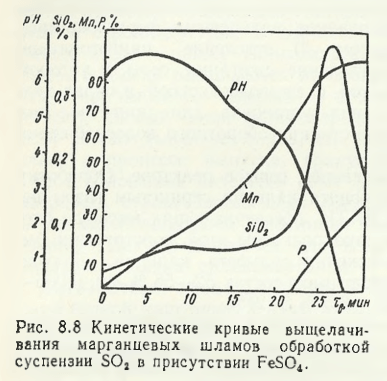
Astfel, la înlocuirea a 50% din zgura cu conținut scăzut de fosfor cu concentrat de ditionat, productivitatea cuptorului a crescut de la 28,2 la 35,84 tone pe zi, iar recuperarea manganului în aliaj a crescut de la 62,8 la 65,08%. În același timp, consumul specific de energie a scăzut cu 18 %, iar cantitatea de zgură reziduală cu 27 %. Cu toate acestea, tehnologia de proiectare a producției de concentrat de ditionat în timpul celor zece ani de cercetare și dezvoltare a instalației s-a dovedit a fi dificil de realizat. Sunt necesare soluții noi și alte abordări pentru ca instalația construită să poată produce concentrate de mangan comercializabile. Deși interacțiunea suspensiilor apoase de minerale de mangan cu dioxidul de sulf a fost studiată în detaliu în condiții de laborator, în condiții industriale, factorul de scară și echipamentele utilizate au făcut ca procesul de ditiionare din versiunea inițială a tehnologiei să fie dificil de aplicat.
Modificarea procedeului cu ditionat propusă de N.M. Gedzem a oferit o creștere a eficienței datorită levigării nămolului prin tratarea suspensiei de SO în prezența FeSo.2 în prezența FeSo4. Datele prezentate în Fig. 8.8 arată că FeSO4 ca agent reducător asigură accelerarea levigării manganului, deși în această variantă, ca și în cea inițială, principala dificultate (rata scăzută de filtrare a nămolului levigat acid) nu a fost eliminată.
În RFG s-a propus transferul manganului din minereu de pirolusit în suspensie apoasă cu ajutorul SO2 și aer. Iar compoziția amestecului de o anumită presiune parțială de SO2 și O2 (ρSO2 : ρO2 = 4-14, de preferință 8-12) se obține ca urmare a utilizării gazului SO2 gazos în formă pură. În acest caz, pH-ul trebuie să fie >4, de preferință 4,2. Controlul raportului ρSO2 : ρO2 raportul este monitorizat prin măsurarea pH-ului fazei lichide a suspensiei. Dacă parametrii recomandați sunt respectați, recuperarea manganului ajunge la 95,3%, iar consumul de sulf este în medie de 110% din cantitatea teoretic necesară.
În Japonia, se propune o metodă de tratare a minereului de mangan zdrobit, care prevede următoarele operații: prepararea unei pulpe apoase din minereu supus prăjirii prin reducere; adăugarea de acid sulfuric în pulpă pentru a aduce pH-ul la 2,8-4,0, amestecarea pulpei la pH 4,0-6,0 și filtrarea pulpei pentru a obține o soluție conținând mangan și un precipitat solid.
Sadunishvili A. S. a propus o metodă de extracție a manganului din materiale cu conținut ridicat de SiO.2care include tratarea materialului inițial cu H2SO4neutralizarea produsului obținut cu amoniac și separarea soluției rezultate de sulfat de mangan de reziduul solid. Pentru intensificarea procesului, materialul inițial este tratat cu H anhidru2SO4 la 250-270 °C timp de 15-20 h.
În Ungaria este dezvoltată o metodă de extracție a manganului din minereuri carbonatice locale sărace prin suflarea suspensiei cu gaze de ardere ale CHPP care conțin până la 0,2 % SO.2. Concentrația manganului în soluție este adusă la 60 g/l. Manganul este precipitat din soluție sub formă de concentrat (62-64 % Mn, 0,01 % P, 0,05 % S, 3-4 % CaO, 0,5 K2O, 1- 2 Na2O). În 1970, a fost pusă în funcțiune o instalație pilot pentru producerea de concentrat de mangan prin această metodă și a fost creat un proiect de instalație de îmbogățire pentru prelucrarea a 280 de mii de tone de minereu de mangan pe an. Minereu de mangan (21 % Mn, 16 % Fe, 0,6 % S, 3,32 % P, 0,35 % Zn, 20,45 % Al2O3, 6,1 % MgO) este măcinat 4 .. Amestecul compus este ars la 550 °C timp de 30-120 min în atmosfera unui cuptor oxidant. Speck-ul este levigat cu apă în raport L : T = 4 : 1 sau 6 : 1. În timpul levigării prin pastă, trecerea SO2 în soluție sub formă de MnSO4. Prelucrarea soluției de MnSO4 soluția poate fi prelucrată prin metode cunoscute. Recuperarea ridicată a manganului în soluție (95 %) se explică prin rolul activ al SO2atât în etapele piro- cât și hidrometalurgice ale procesului. Purtseladze X. G. a dezvoltat o metodă de extracție a manganului din minereuri sărace utilizând sulf elementar ca agent de reducere a pirolusitului în etapa de prăjire a minereului, 2MnO2 + S = 2MnO + SO2și SO2 în etapa de levigare a minereului.
Procedee cu acid azotic
Lixivierea manganului din materii prime cu conținut scăzut de mangan este de obicei clasificată ca un proces circular, deoarece HNO utilizat3 utilizat la capătul circuitului de procesare poate fi regenerat și retrimis în circuit. O caracteristică chimică a procesului cu acid azotic este prăjirea reductivă a materiei prime pentru a transforma MnO2 în MnO. La levigarea produsului prăjit cu acid azotic, manganul trece în soluție, iar oxizii Fe3O4, SiO2și Al2O3nu sunt dizolvate. În procedeul circular Nossen cu acid azotic descris de A. Sully, substanțele care conțin fosfor nu sunt, de asemenea, transferate în soluție. Soluția care conține nitrați de mangan și cantități mici de nitrați de sodiu, potasiu și magneziu este filtrată și evaporată, după care este transferată într-o unitate din oțel rezistent la coroziune pentru descompunere. Procesul se realizează la 200 °C. Evaporarea însoțită de descompunerea soluției de nitrat de mangan se efectuează până la obținerea dioxidului de mangan. Vapoarele de HNO formate în timpul evaporării soluției3 se condensează și, la o concentrație de ~50 % sunt reintroduse în etapa de levigare.
Purtseladze X. G., a cărui mare contribuție la dezvoltarea și cercetarea proceselor chimice de extracție a manganului din materii prime sărace în mangan este bine cunoscută, a sintetizat, într-una din lucrările sale, datele privind îmbogățirea chimică a minereurilor și a nămolurilor sărace cu HNO, regenerarea și revenirea acestuia în etapa de levigare.3, regenerarea acestuia și returnarea în proces. Principalele etape ale acestei tehnologii sunt: zdrobirea și măcinarea minereului, prăjirea reducătoare, levigarea, precipitarea impurităților, filtrarea suspensiei, spălarea nămolului cu apă, evaporarea soluției de nitrat de mangan, calcinarea pentru obținerea concentratului final de mangan comercializabil și returnarea vaporilor de NO absorbiți de apă (tt) la capul de proces.2vapori absorbiți de apă (adică HNO3).
Procesul de prăjire reductivă a materiilor prime care conțin MnO2este descris de reacția
Disocierea carbonaților CaCO3 și MnCO3.
Pentru a reduce MnO2 la MnO, se propune tratarea minereului cu un amestec de gaze, în care raportul dintre aer și CH4 este cuprins între 2 : 1 și 4 : 1 (de preferință între 2,4 : 1 și 3,5 : 1) la 537-1093 °C (de preferință 673-712 °C) cu adăugarea la acest amestec a unor cantități de CO și H4 pentru acțiunea catalitică. Interacțiunea MnO cu HNO3 este însoțită de formarea de nitrat de mangan:
Alături de reacția principală de mai sus, în etapa de levigare a minereului redus, există reacții asociate, care conduc la trecerea în soluție a Mg (NO3)2Al (NO3)3Ca (NO3)2. Fosfatul de calciu se dizolvă prin reacție
Precipitarea impurităților se realizează la pH 4-5, care este însoțită de precipitarea Fe (OH)3Al (OH)3și interacțiunea Fe (OH)3 cu H3PO4 este însoțită de formarea de FePO4 și H2O. Filtrarea suspensiei obținute permite obținerea unei soluții de nitrat de mangan Mn (NO3)2 cu o anumită cantitate de impurități de nitrați de calciu și magneziu.
În cazul prelucrării soluției de nitrat de mangan pentru a obține concentrat de mangan, soluția este evaporată și calcinată la 700-800 °C. În cursul concentrării soluției și apoi al calcinării precipitatului solid, compușii complecși se descompun conform unei scheme generale
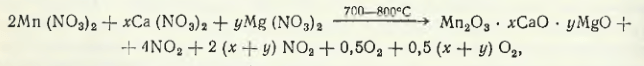
unde x + y este întotdeauna mai mic decât 1.
În funcție de compoziția minereului, conform datelor lui X. G. Purtseladze, suma x + y poate varia de la 0,05 la 0,8. Din materii prime oxidice care conțin mangan s-au obținut concentrate cu 60-70 % Mn și < 0,01 % P. В случае переработки карбонатного сырья содержание CaO + MnO в концентрате повышается. Выделяющиеся оксиды азота адсорбируются водой по схеме 2NO2 + H2O + O2 → 2HNO3 iar sub formă de acid sunt trimise la capul de proces pentru levigarea materiilor prime cu conținut de mangan prereducere.
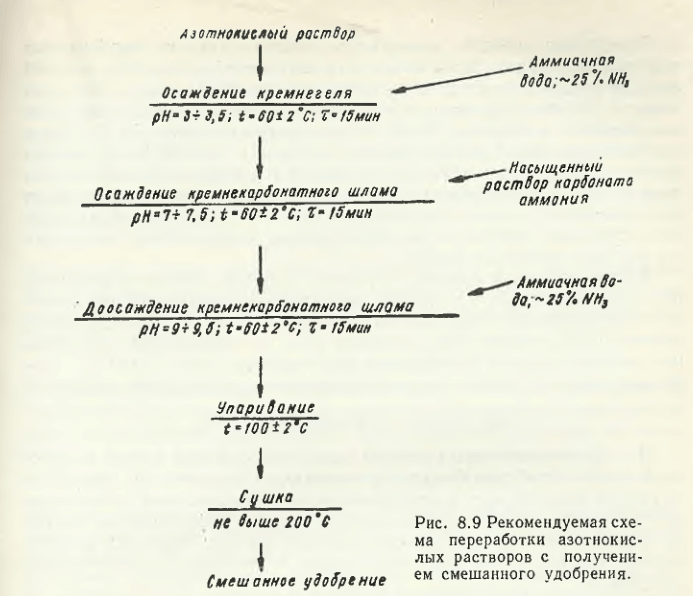
Pe baza nitratului de mangan X. G. Purtseladze a dezvoltat tehnologii pentru producerea de dioxid de mangan activ, permanganat de potasiu, carbonat, nitrat, sulfat și clorură de mangan reactiv. Una dintre schemele propuse de el implică producerea unui îngrășământ mixt (fig. 8.9).
Autorul recomandă obținerea dioxidului de mangan activ prin ozonarea soluțiilor care conțin Mn (NO3)2prin reacție
Procesul de obținere a permanganatului de potasiu este descris schematic prin următoarele reacții:
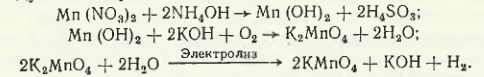
O variantă mai avansată este metoda de obținere a KMnO4atunci când soluția de manganat este oxidată cu ozon prin reacția
care exclude utilizarea electrolizei.
Metodă de levigare acidă a minereurilor carbonate de mangan utilizând în acest scop acid nitric concentrat (este permisă utilizarea H2SO4 sau un amestec al acestor acizi). Și valoarea pH-ului suspensiei după levigarea minereului trebuie să fie între 4-5, iar temperatura nu este mai mică de 70 ° C. Apoi, prin diluare cu apă, concentrația de mangan în faza lichidă este adusă la 70-100 g/l. După centrifugare, la soluție se adaugă o soluție de NH4OH (sau alcalină). Precipitatul de hidroxid de mangan se separă prin filtrare și apoi se calcinează la 700 °C. În paralel se formează îngrășăminte artificiale cu un conținut semnificativ de compuși azotați de calciu și potasiu.
Procedeul clorocalciului
Esența procedeului constă în tratarea în autoclavă a minereului de mangan brut sau prereducut cu soluție de clorură de calciu CaCl2. Potrivit lui N. V. Tolstoguzov, soluția de CaCl2 trebuie să fie saturată cu CO2, iar temperatura de levigare în autoclavă a minereului recopt trebuie să fie de ~160 °С. Chimia procesului în forma generală de levigare este descrisă de reacția
Manganul este precipitat din soluția filtrată sub formă de hidroxid prin tratarea filtratului cu var. Hidroxidul de mangan calcinat este un concentrat de mangan de înaltă calitate (până la 68 % Mn) cu un conținut scăzut de fosfor. Cele de mai sus reprezintă doar o caracterizare generală a procesului clorcalcic, deși sunt necesare noi studii mai detaliate pentru punerea sa în practică.
Tolstoguzov N. V. a analizat solubilitatea sărurilor în sistemul tricomponent CaCl2 — MnCl2 — H2O pe baza datelor privind activitatea componentelor din sistemele binare CaCl2 — H2O și MnCl2 — H2O. Ca rezultat al unui număr de transformări, N.V. Tolstoguzov, folosind ecuația Gibbs-Duhem, a obținut expresia
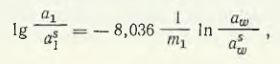
unde a1, a1 s sunt, respectiv, activitățile sării în soluția binară și în soluția saturată cu trei componente; m1 — concentrația de MnCl2 în soluția binară de MnCl2 — H2O; aw s — activitatea apei în punctul soluției binare saturate; aw — activitatea apei.
Studiile au arătat că, de exemplu, la 25 °C și o activitate a apei de 0,46, concentrațiile de MnCl2 (m1) și CaCl2 (m2) sunt de 7,77 și 5,43 mol/100 g H2O. În sistemul tricomponent CaCl2 — MgClCl2 — H2O la aceeași activitate H2O aw concentrațiile calculate de MnCl2(m1) și CaCl2(m2) la 25 °C au fost: m1 = 1,34 mol MnCl2/1000 g H2O; m2 = 4,39 mol CaCl2/1000 g H2O. Pe măsură ce temperatura a crescut până la 200 °C, solubilitatea MnCl2 a crescut la m1 = 1,63 mol/1000 g H2O, în timp ce CaCl2 la m = 7,59 mol/1000 g H2O. P. V. Tolstoguzov a studiat experimental influența parametrilor de levigare asupra recuperării manganului, în special concentrația masică de CaCl2 (x = 47…52 %), temperatura (200-220 °C), durata de levigare (τ = 2…4 h) și gradul de măcinare (s = 0,125…0,220 mm). Prin metoda planificării matematice s-a demonstrat că extracția manganului din minereul bogat în calciu-dochrosit (23,5 % Mn) yp este influențată cel mai mult de concentrația de CaCl2 (х):
În mod similar, efectul creșterii concentrației de CaCl2 asupra recuperării manganului din minereul de rodocrosită. În același timp, în levigarea minereului de manganocalcit, gradul de măcinare s are cea mai puternică influență:
Calitatea concentratului de mangan obținut prin metoda clorocalciului, cu toate celelalte condiții fiind egale, este determinată de conținutul de impurități din varul utilizat pentru precipitarea manganului prin reacție
deoarece consumul specific de Ca (OH)2 este destul de mare. Atunci când se utilizează CaO aproape chimic pur (99,9 %), concentratul conține 62,64 % Mn (sau 89,71 % Mn3O4), 0,0009 % P și 0,002 % S. În cazul preparării laptelui de var folosind 95,6 % CaO, 0,036 % P și 0,05 % S, conținutul de impurități al concentratului a crescut la 0,22 % P și 0,034 % S (la 61,15 % Mn sau 84, 78 % Mn3O4).
Pentru a asigura un conținut scăzut de CaCl2(în experimente a fost de 5-8 %), concentratele trebuie supuse unor spălări repetate cu apă. Tolstoguzov N. V., A. I. Selivanov, I. E. Pronukhin au ajuns la concluzia că CaCl2 în cantități de 3-8 % favorizează peletizarea concentratului prin încălzire până la 700-800 °С. A fost atrasă atenția asupra efectului pozitiv al CaCl2 ca lichefiant al zgurii metalurgice acide și bazice. Problemele metalurgiei clorurilor de mangan sunt analizate în detaliu în lucrările lui Yu. M. Kartvelishvili (Georgia).