Elementul cu numărul atomic 21 „ekabor” și proprietățile sale au fost prezise în 1871 de D.I.Mendeleev. Elementul a fost descoperit de chimistul suedez Nilson în 1879, lucrând la extragerea elementului de pământuri rare ytterbium din mineralul gado-linit. Scandiul metalic cu o puritate de 94-98 % a fost obținut în 1937 de Fischer prin electroliza clorurii de scandiu topită.
Conținut
Proprietăți ale scandiului
Scandiul este un element din subgrupa IIIA a sistemului periodic al elementelor chimice. Un izotop stabil 45 Sc este cunoscut în natură; sunt cunoscuți 12 izotopi radioactivi artificiali.
Unele proprietăți fizice ale scandiului sunt prezentate mai jos:
Masa atomică …………44.9559
Densitate, g/cm 3002,989
Tipul și parametrii rețelei, nm: hexagonal, α = 0,33085, c = 0,5268; OCC (peste 1337 °C)
- topire…….1541 °C
- fierbere………..2836 °С
Capacitatea termică specifică, J/(mol — K), la t, °C:
- 25……..25,52
- 1500……..39,80
Conductivitate termică, V/(cm — K)/000,157
Duritatea Brinell, MPa…….390
Rezistența electrică specifică a probei policristaline p250cμOhm — cm ….. 41 — 51
Scandiul compact este un metal alb-argintiu. Reacționează direct cu oxigenul, halogenii, sulful și carbonul. În aer, pelicula formată pe suprafața metalului împiedică oxidarea ulterioară. Reacționează cu azotul peste 500 ° C cu formarea nitrurii ScN. La încălzire deplasează hidrogenul din apă, se dizolvă ușor în acizi minerali, cu excepția acizilor cromic și fluorhidric, reacționează lent cu o soluție concentrată de hidroxid de sodiu. Raza ionului Sc 3+ (0,083 nm conform lui N.V.Belov și G.V.Bokiy) este mai mică decât raza ionului Y 3+ (0,097 nm) și a ionilor REE cu trei sarcini (0,088 — 0,103 nm). Prin urmare, în compușii de scandiu tendința la hidroliză este mai pronunțată decât în compușii REE similari. Scandiul este predispus la formarea de compuși dubli și complecși cu anioni și liganzi neutri într-o măsură mai mare decât REE.
Cu metalele I, II, VII, VIII subgrupe laterale și II, III, IV, V subgrupe principale din sistemul periodic al elementelor, scandiul formează compuși intermetalici precum СсМе, Sc2Me, ScMe2, ScMe3 și altele.
Elementele III, IV, V și VI ale subgrupurilor laterale formează cu scandiul eutectice sau zone de imiscibilitate în stare lichidă, se manifestă solubilitate în stare solidă.
Proprietăți ale compușilor de scandiu
Scandiul formează compuși corespunzători gradului de oxidare al elementului +3. Alte grade de oxidare nu sunt caracteristice scandiului.
Oxid și hidroxid de scandiu . Oxidul de scdium2O3 — este o substanță albă formată prin oxidarea scandiului de către oxigen, descompunerea termică a hidroxidului, carbonatului, oxalatului, sulfatului, nitratului de scandiu. tпл = 2480 °C, densitate 3,86 g/cm 3 . Este insolubil în apă. Bine solubil în acizi minerali concentrați.
Hidroxidul de scandiu Sc(OH)3 — este un compus amorf. Precipitează prin acțiunea asupra soluțiilor de săruri de scandiu cu amoniac sau soluții alcaline; pH-ul de la începutul extracției este de 4,9. Solubil și în soluții de alcali, carbonați de amoniu, metale alcaline; solubilitatea este puternic redusă în prezența hidroxizilor puțin solubili de fier, mangan etc.
Carbonat de scandiu . Scandiul este caracterizat prin formarea de carbonați bazici [Sc(OH)m]2(CO3)3-m — 3H2O, solubil în soluții de (NH4)2CO3 și Na2CO3 mai bine decât compușii REE similari.
Nitrat de scandiu Sc(NO3)3 — 4H2O este o sare bine solubilă; solubilitate în apă: 61,27% (la 15 °C), 67,60% (la 50 °C).
Sulfatul de scandiu Sc2(SO4)3formează hidrați cu 2; 4; 5 și 6 molecule de apă. Solubilitate în apă 28,53% (la 25 °C). Cu sulfații metalelor alcaline formează compuși Me[Sc(SO4)2], sau K3(Sc(SO4)3] este de 20 de ori mai puțin solubil în soluție de K decât compușii similari ai elementelor de ytriu.2SO4decât compușii similari ai elementelor din subgrupul ytriului al REE.
Fosfat de scandiu ScPO4 — 2H2O este puțin solubil, se obține prin acțiunea acidului fosforic asupra soluției apoase de săruri de scandiu.
Oxalat de scandiu Sc2(C2O4)3 — nH2O (n ≈ 3; 4; 5; 6; 18) se formează prin acțiunea acidului oxalic asupra soluțiilor neutre sau ușor acide de săruri de scandiu. Malosolubil, PRSc2(C2O4)3 = 1 0-27 .
Iodat de scandiu Sc(IO3)3 — 1,5H2O este bine solubil, spre deosebire de compușii similari de toriu și zirconiu.
Fluorură de scandiu ScF3 — substanță cristalină albă, t = 1552 °C, tpunctul de fierbere = 1607 °С. Puțin solubilă, PRScF = 3 — 1 0-20 . Când este tratat cu H concentrat2SO4 se transformă în sulfat, iar când este încălzit în soluție de NaOH — în hidroxid. Solubil în HF, soluții de fluoruri de metale alcaline și amoniu; în soluție se formează complecși [ScF4]- , [ScF6]3- .
Clorură de scandiu ScCl3 — substanță cristalină albă, higroscopică, tпл = 968 °C, tpunctul de fierbere = 975 °С. Dependența de temperatură a presiunii vaporilor (MPa): lgP = -14200/T + 10,49 (1066 — 1229 K).
Cristalohidrat ScCl3 -6H2O, atunci când este încălzit în aer, se transformă mai întâi în oxoclorură ScOCl, puțin solubilă în apă, acizi și baze, apoi în Sc2O3.
Carbura de scandiu ScC este mai studiată decât celelalte carburi de scandiu. Se obține prin sinteză din substanțe elementare sau prin reducerea Sc2O3 carbon. Punctul de topire este de 1800 °C, microduritatea este de 26,7 GPa.
Aplicații ale scandiului
Scandiul și compușii săi sunt utilizați în prezent în producția de aliaje ușoare, inginerie electronică, inginerie de iluminat și producția de ceramică specială. Posibilitățile de aplicare a scandiului sunt limitate de prețul ridicat. În 1988, oxidul de scandiu (1 g) costa 2,8 USD, în timp ce metalul distilat (puritate 99,99%) costa 15 USD. Prețul ridicat este asociat cu volumele mici de producție (aproximativ 100 kg pe an în termeni de metal). Principalii producători de produse din scandiu sunt RPC și Franța.
Aliaje ușoare
Scandiul prezintă interes ca material structural pentru construcția de rachete și aeronave, astronautică, deoarece are un punct de topire mult mai ridicat decât aluminiul și aceeași densitate. De interes deosebit sunt aliajele Al — Sc, Mg — Sc, Mg — Sc — Li, Mg — Y — Sc. Deoarece adaosul de zecimi de procent de scandiu la aluminiu și la aliajele sale determină o creștere a rezistenței, în anumite cazuri a proprietăților plastice, o rezistență sporită la fisurarea prin coroziune, o mai bună sudabilitate a semifabricatelor deformate. În timpul cristalizării topiturii în procesul de formare a lingourilor, cea mai mare parte a scandiului intră în soluția suprasaturată, iar partea rămasă este eliberată sub formă de Al3Sc (Fig. 89), care provoacă măcinarea grăuntelui turnat.
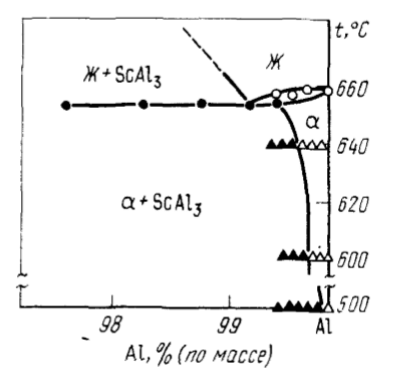
Alierea a 0,4% scandiu în aliajele Al — Mg (2 — 8,5 Mg) crește rezistența la tracțiune cu 20 — 35 % și limita de elasticitate cu 60 — 80 %. În același timp, alungirea relativă rămâne destul de ridicată (15 — 20 %).
Tehnologie electronică
Un domeniu important de aplicare a oxidului de scandiu este producția de ferite pentru calculatoare cu inducție de 0,08 — 0,1 Tesla, care este de 3 ori mai mică decât feritele din oxizi de fier, magneziu și mangan. Aceste ferite sunt mai puțin supraîncălzite în timpul remagnetizării, ceea ce crește performanța memoriei magnetice a computerului.
Tehnologia de iluminat
Pentru iluminarea clădirilor industriale și a instalațiilor sportive se utilizează lămpi cu mercur de tip matalohalid (iodură) cu aditivi de scandiu.
Producția de ceramică
Diferite tipuri de ceramică pe bază de ZrO2 și HfO2 cu Sc2O3Au fost dezvoltate ceramici pe bază de ZrO și HfO cu aditivi Sc, care funcționează cu succes la temperaturi ridicate.
Alte aplicații
Hidrură de scandiu este utilizată în ingineria nucleară ca moderator de neutroni la temperaturi înalte. Borura de scandiu ScB2 este propusă pentru a fi utilizată ca o componentă a aliajelor ușoare rezistente la căldură, precum și în materialele catodice pentru dispozitive electronice. Oxidul de scandiu este o componentă a ochelarilor optici germanați și a luminoforilor.
Sursele de materii prime ale scandiului
Scandiul este un element litofilic difuz tipic. Conținutul său în scoarța terestră este de 1 0-3 % (în masă). Nu formează zăcăminte proprii.
Mineralele proprii ale scandiului sunt tortveitita Sc2[Si2O7] și steretită ScPO4 — 2H2O sunt foarte rare și nu au valoare industrială. Mai răspândite sunt mineralele în care scandiul este prezent sub formă de impuritate izomorfă în cantitate de 0,005 — 0,3% Sc2O3. Mineralele purtătoare de scandiu (oxizi, carbonați, silicați, fosfați, wolframați) conțin ioni caracterizați de o rază ionică apropiată de Sc 3+ (0,083 nm), nm: Fe 2+ 0,080, REE 0,102 până la 0,080, Mg 2+ 0,074, Ca 2+ 0,104, Mn 2+ 0,091, Zr 4+ 0,082, Th 4+ 0,095 și U 4+ 0,089. Izomorfismul se datorează, de asemenea, proximității altor constante cristalochimice ale scandiului și ale elementelor enumerate.
Problema producției industriale de scandiu poate fi rezolvată prin utilizarea subprodusului de scandiu dispersat extras din minereurile de metale neferoase și rare. Concentrarea scandiului în deșeurile de producție (soluții, nămoluri, zgură etc.) creează condiții pentru extracție fără a perturba tehnologia principală.
Materii prime de titan
Materiile prime de titan conțin Sc2O3 (până la 0,1 % în ilmenit, până la 0,3 % în sphene). În timpul îmbogățirii concentratelor de ilmenit prin electrofuziune reductivă, scandiul este transferat în zgura de titan.
Minereuri purtătoare de zirconiu
Zirconii și alte minerale de zirconiu conțin 0,001 — 0,08 % Sc2O3. Atunci când concentratul de zircon este prelucrat prin sinterizare cu var și clorură de calciu, scandiul este concentrat în principal în mată după extracția sulfatului de zirconiu bazic.
Minereuri de tungsten
Conținutul de Sc2O3 în wolframite este de 0,005 — 1,0 %. La prelucrarea hidrometalurgică, care include sinterizarea concentratului de Na2CO3 concentrat și levigarea ulterioară, scandiul rămâne în turta de levigare, iar conținutul său crește de 2 — 3 ori în comparație cu conținutul din wolframit.
Minereuri de uraniu
Minereurile de uraniu conțin 1 0-3 — 1 0-4 % Sc2O3. Atunci când minereurile de uraniu sunt deschise cu acizi sulfurici sau nitrici, scandiul trece în soluție împreună cu uraniul. La deschiderea minereurilor cu Na2CO3scandiul este concentrat în principal în turtele de levigat.
Minereuri de aluminiu
Bauxita conține 0,001 — 0,01 % Sc2O3. Datorită prelucrării la scară largă, bauxita poate fi o sursă importantă de scandiu. Atunci când bauxita este prelucrată prin metodele Bayer și sinterizare, scandiul este reținut în principal în nămolul roșu.
Alte surse de scandiu
Alte surse de scandiu includ unele minereuri de staniu (0,001 — 0,005 % Sc2O3), minereuri de staniu (0,02 — 0,22 % Sc2O3), concentratele de beriliu (0,1 — 0,2 % Sc2O3), cenușa unor cărbuni (0,01 % Sc2O3), rocă fosfatică.
Prelucrarea materiilor prime care conțin scandiu
Conținutul de scandiu în produsele de prelucrare a materiilor prime minerale este de sutimi până la zecimi de procente. Prin urmare, din produsele inițiale se obțin mai întâi concentrate, care sunt apoi transformate în compuși de scandiu.
Pentru a extrage scandiul din produse în soluție, se utilizează levigarea acidă (de exemplu, acid clorhidric), descompunerea prin clorinare, acid sulfuric sau hidroxid de sodiu urmată de levigare apoasă sau acidă.
Următoarele metode principale sunt utilizate pentru izolarea scandiului din soluții:
- precipitarea ca parte a compușilor puțin solubili,
- extracția cu solvenți organici,
- metode de schimb de ioni.
Metode de precipitare
Precipitarea cu hidroxid
Precipitarea cu hidroxizi este utilizată pentru separarea metalelor alcaline și alcalino-pământoase:
Din datele din tabelul 11 rezultă că este posibil, folosind diferența de pH a precipitării hidroxidului, să se purifice într-o oarecare măsură scandiul de Zr, Ti, Th și Ce (+4), deoarece acestea precipită la un pH mai scăzut decât hidroxidul de scandiu, și de o serie de ETR și Fe (+2), precipitate la valori mai ridicate ale pH-ului. Metoda nu permite separarea Fe (+3), în prezența căruia Sc(OH)3 precipită la valori mai scăzute ale pH-ului, și de aluminiu, care are o valoare apropiată a pH-ului de precipitare. Metoda este simplă, cu dezavantajul filtrării slabe a precipitatelor.

Precipitarea oxalatului
Ca urmare a precipitării oxalatului de scandiu.
este posibilă separarea scandiului de aluminiu și fier. Cu exces de acid oxalic, precipitarea este incompletă datorită formării anionului complex [Sc(C2O4)3] 3- . Condiții de precipitare: pH = 2÷3, temperatura 90 °C, durata 4 h.
În separarea oxalatului de scandiu, în special din soluții sărace, o precipitare mai completă favorizează prezența calciului, care joacă rolul de purtător.
Pentru separarea de REE, se utilizează diferența de stabilitate a compușilor complecși formați de oxalații de scandiu și REE și EDTA.
La fierberea unei soluții care conține acești compuși complecși, compușii ETR mai puțin puternici se descompun, iar ETR pot fi izolați din soluție sub formă de oxalați. După separarea soluției prin introducerea acidului oxalic solid, scandiul este izolat sub formă de precipitat.
Precipitarea carbonatului
Spre deosebire de compușii REE, Fe, Mn, Ca, carbonatul de scandiu se dizolvă în soluție în exces de Na2CO3 sau (NH4)2CO3 cu formarea de compuși complecși, a căror utilizare este recomandată pentru purificarea din REE, Fe, Mn, Ca:
Complexul de carbonat este distrus prin fierbere. Se precipită carbonatul de scandiu slab solubil cu compoziție variabilă.
Dezavantajul tratamentului cu carbonat este necesitatea de a utiliza un volum mare de soluții de carbonat de sodă sau de amoniu din cauza solubilității moderate a compușilor de scandiu în acestea și a capacității reduse de filtrare a precipitatelor.
Precipitarea fluorurii
ScF3 — este puțin solubil, dar se dizolvă (spre deosebire de fluorurile de ETR și toriu) în NH4F cu formarea de fluoroscandat:
Fluorurile și silicofluorurile de sodiu și potasiu, acidul fluorhidric, acidul hidrogen silicofluoric sunt utilizate pentru extracția fluorurii de scandiu din soluții sărace; precipitantul este luat în exces.
Dezavantajul metodei este dificultatea transformării fluorurii de scandiu într-o stare solubilă. Acest lucru necesită tratarea cu acid sulfuric concentrat la 180 — 250 °C sau cu soluție de NaOH 20 — 30% la 60 — 80 °C timp de 2 — 3 ore.
Schimb de ioni
- pentru separarea compusului de scandiu din soluția diluată;
- pentru purificarea soluțiilor de compuși de scandiu de impurități.
Pentru a crește eficiența purificării scandiului de impuritățile cele mai dificil de separat (REE, Y, Th) se utilizează o combinație de separare prin schimb ionic pe cationiți cu complexare (în desorbție). Desorbanți buni sunt acidul citric și acidul etilendiaminetetetraacetic. Stabilitatea compușilor complexați crește într-o serie de La < Y < Yb < Sc, так что при десорбции в первую очередь вымывается скандий.
1) trecerea unei soluții cu amestecul de separat printr-o coloană de rășină sub formă de amoniu sau hidrogen (etapa de sorbție):
2) desorbția ionilor prin soluție de acid citric (sau EDTA):
Extracția
Una dintre cele mai dezvoltate metode este extracția complexului de rodanidă H[Sc(CNS)4] cu eter dietilic din soluții de clorură sau nitrat. Coeficienții de distribuție ai scandiului și ai unui număr de co-elemente sunt foarte diferiți (pH = 3,5):

Înainte de extracție, Fe(+3) este redus la Fe(+2). Scandiul se extrage din nou prin tratarea repetată a extractului cu apă. Dezavantajul metodei este inflamabilitatea extractantului, consumul ridicat de rodanură de amoniu.
Alți extractanți utilizați în tehnologia scandiului: TBP, eteri dialchilici ai acidului alchilfosforic (DAAF), D2EGPC etc. Extracția scandiului prin TBP și DAAF se realizează în medii puternic acide, în prezența unor agenți de desalinizare (cloruri sau nitrați de calciu și magneziu). Extracția scandiului prin TBP din soluții de clorură are loc prin formarea de solvenți ScCl3 — xTBF (x variază de la 2 la 3 în funcție de condițiile de aciditate și de prezența agenților de levigare). Coeficientul de distribuție al scandiului la extracția TBP din 6 n.HCl este 3,2, iar cel al ytriului — 0,001 (adică factorul de separare este 3200). Scandiul se extrage din nou cu HCl diluat.
Acizii alchilfosforici au o selectivitate mai mică decât TBP și, împreună cu scandiul, extrag zirconiu, toriu, titan, fier, uraniu etc., astfel încât acești extractanți sunt utilizați în principal pentru extracția scandiului. Prin urmare, acești extractanți sunt utilizați în principal pentru extracția scandiului din soluții sărace (acide sau neutre) în scopul concentrării. Din soluțiile neutre, extracția are loc prin mecanismul schimbului de cationi datorită formării sării de scandiu cu acidul organic solubil în acest acid:
unde HnX — acid alchilfosforic. Dezavantajul metodei constă în faptul că scandiul poate fi re-extractat numai cu acid fluorhidric sau soluție alcalină, rezultând un precipitat greu de filtrat ScF3 sau Sc(OH)3.
Exemple de prelucrare a materiilor prime care conțin scandiu
Prelucrarea tortveititei
Există următoarele metode:
- Acidă (stripare cu HCl, H2SO4NH4HF2acid fluorhidric);
- alcaline (aliere cu NaOH, sinterizare cu Na2CO3);
- carbură;
- clorinare.
Decaparea acidă necesită repetări multiple ale procesului. În decaparea la temperaturi înalte cu alcaline sau sodă
scandiul rămâne în reziduu după levigarea apoasă a sinterizării. Reziduul este dizolvat în HCl; amoniacul precipită hidroxidul de scandiu. Hidroxidul se dizolvă în 6 — 8 n. HCl și se extrage cu eter, separându-se fierul. Impuritățile rămase se separă prin extragerea rododanidului de scandiu cu eter. După distilarea eterului, scandiul este precipitat sub formă de tartrat dublu cu amoniu; recuperarea este de 96 %.
Metoda carburilor constă în formarea de carburi ca urmare a încălzirii la 1800 — 2100 °C a amestecului de mineral și cărbune (raport 1:1,2). Când carburile sunt tratate cu acid clorhidric, Sc, REE, Al, Fe, Ti, Zr trec în soluție. Acidul clorhidric aproape că nu descompune carbura de siliciu. Oxalatul de scandiu este precipitat din soluție; după repetate reprecipitări, se obține un concentrat bogat de scandiu care conține 10 % de oxizi de ETR. Purificarea ulterioară se realizează prin precipitarea fracționată a hidroxizilor și prin schimb ionic.
La prelucrarea prin clorinare, tortveitita amestecată cu cărbune este încălzită într-un curent de clor la 900-1000 °C. Diferența dintre temperaturile de fierbere și de condensare ale clorurilor elementelor care alcătuiesc mineralul face posibilă separarea lor în procesul de condensare. Clorurile de Si, Zr, Al, Fe, Ti condensează sub 400 °C; ScCl3 — la 600 — 900 °C; randamentul este de 87,5 %. Clorurile de ETR rămân în zona de clorinare din topitură.
Prelucrarea minereurilor de uraniu-toriu
Schema tehnologică a uzinei de uraniu din Salt Lake City (SUA, Utah) produce soluții care conțin 0,001 g/litru de Sc2O3. În timpul extracției uraniului cu soluție 0,1 M de acid dodecilfosforic în parafină, scandiul trece în extract împreună cu uraniul, toriul, titanul. Uraniul se reextragează cu HCl 10 n; scandiul rămâne în faza organică împreună cu toriul și titanul și se concentrează la 0,1 g/l Sc2O3. Fluorurile de scandiu și toriu sunt precipitate din extractant prin acțiunea acidului fluorhidric. Tortul de scandiu-toriu care conține 10 % Sc2O3 și 20 % ThO2Tortul de fluorură este prelucrat pentru a extrage scandiul. Tortul de fluorură este deschis cu soluție IaOH 15 % la 75-90 °C timp de 4 ore. Hidroxizii formați se tratează cu acid clorhidric la 100 °C, stabilindu-se pH = 4; astfel se realizează purificarea de Zr, Th, Ti, Si parțial de Fe (III), care rămân în precipitat. Scandiul este precipitat din soluție cu acid oxalic. Oxalatul de scandiu se filtrează, se usucă, se calcinează.
Pentru a obține o puritate de Sc2O3 cu o puritate mai mare de 99,5 % se efectuează o purificare suplimentară de impurități prin metoda extracției după dizolvarea Sc2O3 în acid clorhidric. Se extrage cu eter dietilic în prezența NH4CNS. Din faza organică, scandiul se reextrage cu apă și se precipită cu amoniac sub formă de hidroxid; prin calcinare la 700 °C, hidroxidul se transformă în Sc2O3.
Pentru a extrage scandiul împreună cu uraniul din soluții de acid sulfuric după levigarea minereului de uraniu (uzina Port Pirie, Australia), se utilizează D2EGPC. După re-extragerea uraniului, scandiul se acumulează în faza organică. După tratarea cu sodă a extractului, se obține un tort care conține, %: Sc 0,14, Th 0,14, Ti 0,3, și U3O8 24, Fe 38. Schema tehnologică prezentată în figura 90 permite extragerea a 90 % din Sc din turtă și obținerea oxidului de scandiu cu o puritate de 99,6 %.
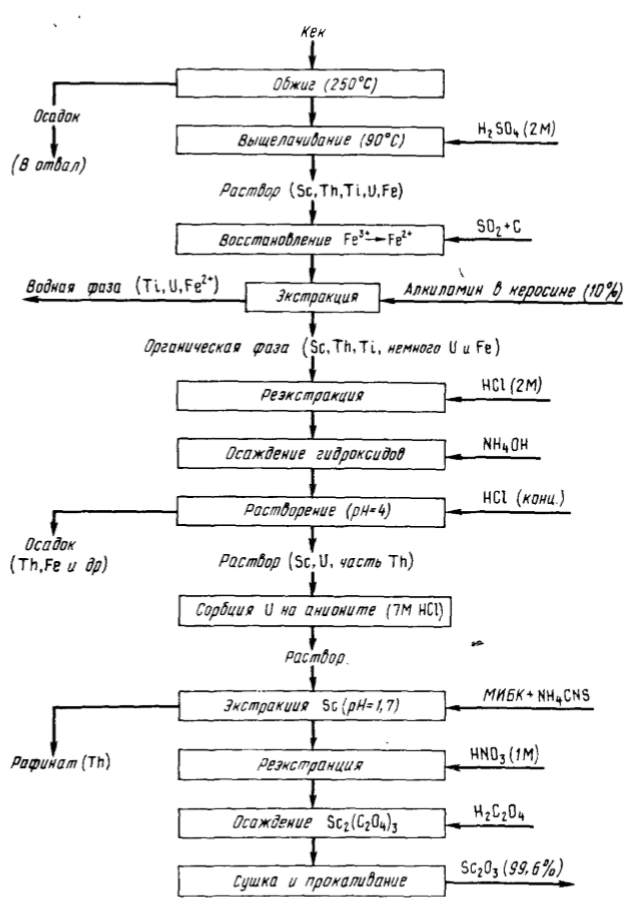
Conform acestei scheme, turta este deschisă cu acid sulfuric, scandiul este concentrat prin extracție cu o soluție de 10% de alchilamină primară. În același timp, 97 % Sc, 97 % Th, 55 % Ti, 7 % U, 2 % Fe trec în extract, Fe (III) preliminar este redus cu SO2în prezența carbonului activ la Fe (II). După re-extracție cu 2 n HCl, raportul scandiu/ impurități se modifică de la 1:410 la 1:10. Operațiile ulterioare implică purificarea suplimentară a scandiului. Scandiul este separat de uraniu prin sorbție pe anionit, de toriu prin extracția complexului de rodanură de scandiu cu metilizobutilcetonă. Scandiul este separat în final în oxalat, care se transformă în oxid la calcinare.
Prelucrarea concentratelor de titanomagnetită
Zgură de titan obținută ca urmare a topirii reductive a titanomagnetitelor conține 0,005 — 0,009 % scandiu. La clorinarea zgurii, cea mai mare parte a scandiului din compoziția clorurii este concentrată în topitura uzată a clorinatorilor de titan (până la 0,01 — 0,03 % Sc2O3). Topitura este tratată cu soluție de HCl (20 — 40 g/l), levigând scandiul. Soluția se filtrează, conținutul de Fe(III) se corectează, scandiul se extrage cu soluție TBP 70% în parafină. S-a constatat că FeCl3 favorizează extracția scandiului cu TBP, cu toate acestea, creșterea conținutului de FeCl3 în soluție duce la contaminarea extractantului. În plus, FeCl3 formează un compus cu TBP, care are solubilitate limitată în TBP, ceea ce duce la îngroșarea fazei organice și la formarea unei emulsii. Concentrația optimă de FeCl3 în soluția inițială este de 7-12 g/litru. Ajustarea conținutului de FeCl3înainte de extracție este reducerea Fe 3+ :
Extractul îmbogățit cu scandiu se spală de impurități cu acid clorhidric (220 — 240 g/l), scandiul se re-extrage cu soluție de HCl 7%. Oxalații de scandiu și alte elemente se precipită din re-extract cu acid oxalic, pulpa se filtrează, precipitatul se usucă și se calcinează la 700 °C, obținându-se oxid de scandiu tehnic cu un conținut de 40 — 60% Sc2O3.
Oxidul de scandiu tehnic se dizolvă în acid clorhidric, scandiul se extrage cu TBP, din re-extract, după redepuneri multiple de iodați [purificare de Th (IV) și Zr (IV)], hidroxizi și oxalați, se obține oxid de scandiu comercial care conține peste 99,9% Sc.2O3.
Reciclarea deșeurilor de la producția de wolfram și staniu
Tortul rezidual de la prelucrarea hidrometalurgică a concentratelor de wolframită constă în principal din oxizi de fier (25 — 35 %) și mangan (25 — 35 %), conține Nb, Ta, Th, U, Sn REEs și 0,15 — 0,50 % Sc2O3. Pentru extracția scandiului sunt cunoscute metode de clorinare, stripare cu acid clorhidric sau sulfuric.
O recuperare mai mare de scandiu a fost obținută ca urmare a deschiderii turtei cu acid sulfuric 98 % la 220 °С (T:L = 1:1,4) (Fig.91). La levigarea apoasă cea mai mare parte din fier (15 — 25 g/l), mangan (15 — 20 g/l), Zr, Ti, Th, REE, Al și alte impurități trec în soluție împreună cu Sc (0,2 — 0,3 g/l). Fierul și aluminiul se separă prin metoda carbonatului, pe baza capacității scandiului de a forma carbonați complecși cu carbonatul de sodă și de amoniu, solubili în exces de carbonatul corespunzător.
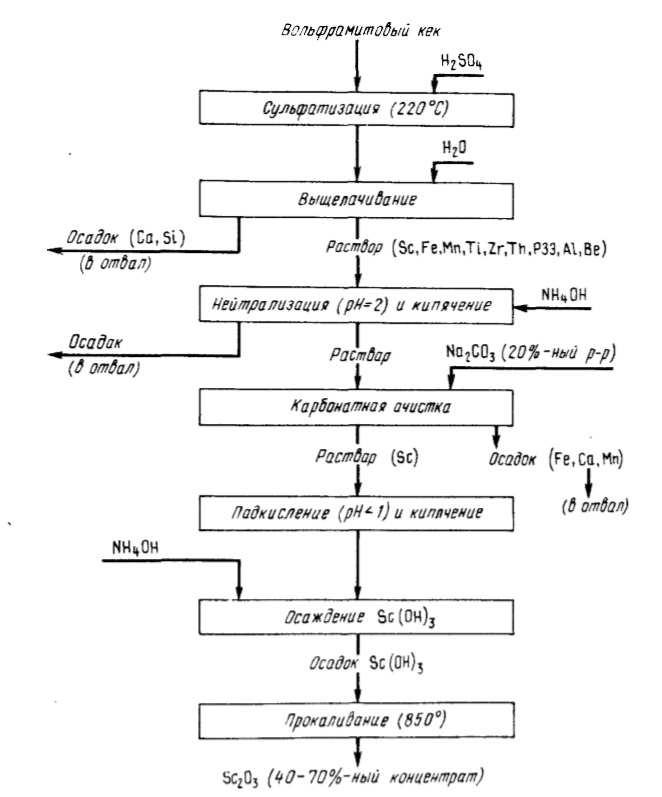
După acidificare cu HCl până la pH = 1 și fierbere, Sc(OH) este precipitat din soluție prin adăugarea de Sc(OH) concentrat în soluție.3prin adăugarea unei soluții concentrate de amoniac. Prin calcinarea hidroxidului se obține 40 — 70 % Sc(OH).2O3. Purificarea suplimentară de impuritățile de Ti, Zr, Th, ETR se realizează prin metode de extracție utilizând diferiți extractanți. Extracția scandiului este de 80 — 88 %, puritatea Sc2O3 99,99 %.
Prelucrarea zgurii de producție de ferotungsten și staniu
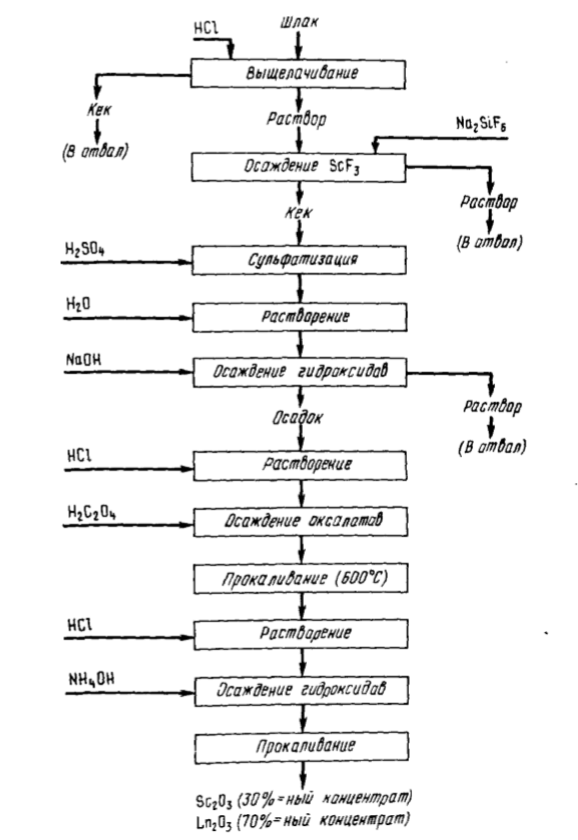
Schemele tehnologice de extracție a scandiului din aceste tipuri de materii prime au fost dezvoltate în URSS. Prelucrarea pirometalurgică a concentratelor de wolframită pentru ferotungsten și topirea concentratelor care conțin staniu produc zgură cu un conținut de scandiu de 0,04 — 0,25 %. Principalele impurități sunt Fe, Si, Al, Ca, Ti, Mn, uneori Th, REE. Din ambele tipuri de zgură se propune extragerea scandiului prin tratarea materialului zdrobit cu 18 % HCl la 80 — 90 ° C (T:L = 1:1÷5). Până la 96% din Sc este extras în soluție. Pentru separarea de cantitățile principale de fier și mangan, scandiul este precipitat ca parte a fluorurii puțin solubile prin introducerea silicefluorurii de sodiu în soluție la pH = 2. Precipitatul de fluorură de scandiu care conține Ca, Al, REE, Ti, Mn este tratat cu acid sulfuric și apoi se efectuează levigarea apoasă. O parte din calciu rămâne insolubil ca parte a CaSO4. Pentru a separa precipitațiile de aluminiu și calciu se precipită hidroxizi, introducându-se NaOH, la pH = 10. Aceste impurități rămân în soluție; titanul, manganul și Sc(OH) precipită împreună cu Sc(OH).3 Titanul, manganul și alte impurități sunt precipitate. Precipitatul de hidroxizi este dizolvat în acid clorhidric, iar scandiul este precipitat cu acid oxalic. Oxalații sunt transformați în oxizi prin calcinare. După dizolvarea în HCl, precipitarea hidroxizilor și calcinarea acestora, se obține un concentrat care conține 30 % Sc2O3 și 70 % (ETR)2O3. Recuperarea zgurii ~76 %. Schema procesului este prezentată în Fig. 92.
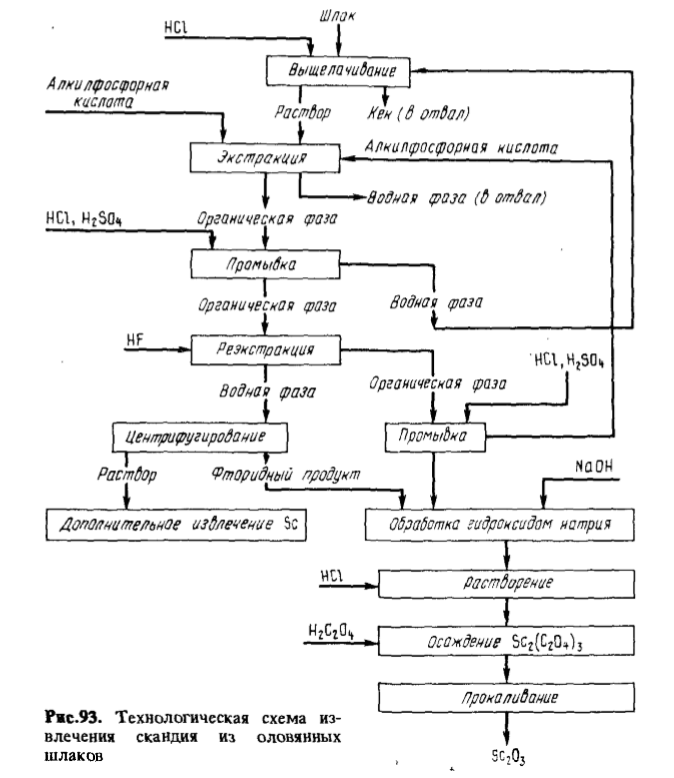
A fost dezvoltată și testată în condiții industriale o metodă de extracție, concentrare și purificare a scandiului obținut din zgura rezultată din topirea concentratelor de staniu. Schema procesului este prezentată în figura 93. După levigarea zgurii cu acid clorhidric, se prepară o soluție care conține, g/litru: Sc 0,2 — 1,0, Ti 0,8 — 3, Si 0,1 — 2, Ca 11 — 30, Sn 0,1 — 1, Al 3,5, Mg 0,5 — 1,6, Zr până la 2,6, Fe 0,5 — 2, W 0,03, HCl 110. Scandiul se extrage cu 0,3 M D2EGPC în parafină la un raport volumic de 10:1 între faza apoasă și faza organică. Faza organică se spală cu 15 % HCl la un raport de fază de 1:1 și apoi cu 45 % H2SO3 la același raport de fază. Scandiul se reextrage cu acid fluorhidric. După separare prin centrifugare, fluorura este tratată cu soluție de NaOH, transformându-se în Sc(OH)3; apoi se efectuează purificarea cu oxalat. Recuperarea directă a scandiului este de 75 %.
Producția de scandiu
Scandiul metalic a fost obținut pentru prima dată în 1937 de V. Fischer prin electroliza topiturii de cloruri de scandiu, potasiu și litiu la 700 — 800 °C pe un catod lichid din zinc chimic pur. Din aliajul de zinc cu 2 % Sc, zincul a fost distilat în vid. Ca rezultat, s-a obținut scandiu spongios de puritate 94 — 98 %, care conține fier și siliciu.
În prezent, scandiul este obținut în principal prin metoda metalotermală prin reducerea ScF anhidru3 sau ScCl3magneziu sau calciu într-o atmosferă inertă (ΔG°298ScCl2 = -857 kJ/mol; ΔG°298CaCl2 = -727 kJ/mol):
2ScCl3 + 3Ca = 3CaCl2 + 2Sc (12.11)
Procesul se realizează în creuzete din tantal sau molibden. Datorită faptului că scandiul și zgura se separă la temperaturi de peste 1600 °C, fluorura de scandiu se reduce mai întâi la 850 °C, crescând temperatura la 1600 °C la sfârșitul procesului. După separarea zgurii, metalul este topit din nou într-un vid de 1 0-3 Pa pentru a elimina impuritățile volatile reziduale. Păstrând același vid, scandiul este exhumat la 1700 °C. Randamentul de metal pur atinge 95 %. Pentru a reduce contaminarea scandiului cu tantal, se recomandă adăugarea de metale care formează aliaje cu scandiul și permit reducerea la o temperatură mai scăzută. În cazul reducerii termice a magneziului, excesul de magneziu este preluat pentru a forma aliajul Sc- Mg. În reducerea calciului, se adaugă zinc, deoarece nu se formează aliajul Sc — Ca. Pentru a scădea punctul de topire al zgurii, se introduce LiF. Schema de reducere:
2ScF3 + 3Ca + 8Zn + 12LiF = 2(Sc — 4Zn) + 3(CaF2 — 4LiF) (12.12)
Procesul se realizează în argon la 1100 °C. Zincul și impuritățile de calciu se distilează în vid. Buretele de scandiu este topit din nou. De asemenea, este cunoscută o metodă de reducere a ScF3 prin aluminiu:
ScF3 + 3Al = Sc + 3AlF
Reacția începe la 810 °C. Reducerea completă a scandiului are loc la 930 °C în 7 — 8 min. Prin reducerea clorurii de scandiu cu calciu la 900 °C în mediu argon, se poate obține metal contaminat cu impurități de Ca, CaO, CaCl2Si, ScCl3. Impuritățile, cu excepția siliciului, se îndepărtează prin spălare cu apă. Siliciul este separat prin tratare cu soluție de NaOH 10%. Uscat în aer și apoi în vid (1 0-2 Pa) metalul după topire în vid (1 0-3 — 1 0-4 Pa) la 500 — 600 ° C are o puritate de 97 — 97,5 %. Un grad de puritate mai ridicat (peste 99 %) se obține prin distilarea în vid (1 0-4 Pa).
Metoda de obținere a scandiului prin electroliza topiturii de fluoroskandat de sodiu, în care 2 % Sc2O3 la 800 °C în mediu argon. Metalul eliberat este separat mecanic în mod continuu; cantitatea necesară de fluoroskandat de sodiu și oxid de scandiu se adaugă la electrolit.