Metalele sunt cel mai răspândit tip de materiale cu care omul își satisface nevoile vitale. Acum omenirea trăiește în epoca metalelor, iar dezvoltarea tuturor industriilor, științei, culturii și vieții umane este de neconceput fără mașini, mecanisme, dispozitive și alte produse fabricate din metal.
06.11.2016 Subiect: Fundamente ale metalurgiei neferoase Autor: Paxey

În acest articol:
Metalele sunt cel mai răspândit tip de materiale cu care omul își satisface nevoile vitale. Acum omenirea trăiește în epoca metalelor, iar dezvoltarea tuturor industriilor, științei, culturii și vieții umane este de neconceput fără mașini, mecanisme, dispozitive și alte produse fabricate din metal.
Introducere
Trecerea omului de la utilizarea pietrei (epoca de piatră) la metal a fost lungă și complexă. Ea nu a avut loc ca urmare a unui salt revoluționar în dezvoltarea societății, ci metalele au fost introduse treptat în viața omului pe o perioadă lungă de timp. Primul metal care a intrat în viața de zi cu zi a omului a fost cuprul, care a deschis era metalurgiei și a dat lumii primul său aliaj — bronzul. Conform datelor arheologice, primele informații despre topirea cuprului datează din 6500-5700 î.Hr. Acesta a fost baza culturii materiale timp de mii de ani, iar epoca cuprului a trecut treptat la epoca bronzului.
Următoarea etapă a metalurgiei a fost utilizarea fierului (Epoca Fierului), iar începutul său este atribuit mileniului al doilea î.Hr. Producția de fier pur și a aliajelor sale a devenit posibilă datorită experienței acumulate în topirea cuprului, bronzului, aurului și a altor metale și aliaje ușor de topit. Stăpânirea producției de fier a constituit un impuls puternic pentru dezvoltarea forțelor de producție și a progresului tehnic. În antichitate, omul cunoștea opt metale — cupru, aur, argint, staniu, plumb, fier, mercur și antimoniu. Până la sfârșitul secolului al XVIII-lea, numărul lor a crescut la 20, iar în prezent se produc și se utilizează aproximativ 80 de metale.
Prevalența elementelor în scoarța terestră variază de la câteva procente la milionimi. Conținutul total al celor mai comune zece elemente (oxigen, 47,00; siliciu, 29,50; aluminiu, 8,05; fier, 4,65; calciu, 2,96; sodiu, 2,50; potasiu, 2,50; magneziu, 1,87; titan, 0,45; hidrogen, 0,15) reprezintă 99,63 % din masa crustei, în timp ce toate celelalte elemente reprezintă doar 0,37 % din masa totală a Pământului. O idee despre prevalența în scoarța terestră a unor metale bine cunoscute este dată de valorile clark-urilor lor, adică conținutul mediu aritmetic în scoarța terestră, care sunt prezentate mai jos (%):
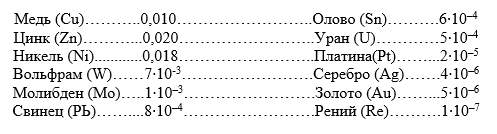
Poloniul și actiniul sunt cele mai rare în natură, clarcurile lor fiind apropiate de 1 0-15 %.
Importanța tehnică a metalelor este determinată de prezența lor în natură, de necesitățile economiei naționale și de capacitățile de producție obținute. Ultimii doi factori determină scara de producție a anumitor tipuri de metale. În producția de metale, aproximativ 95% din producție (aproximativ 800 de milioane de tone) sunt fontă și oțel, care sunt aliaje de fier cu carbon și alte componente de aliere. Producția anuală a principalelor metale neferoase este de (milioane de tone): aluminiu 23-24; cupru 10-11; nichel 0,5-0,7; plumb 4-5; zinc 5-6; magneziu 0,2-0,3; staniu 0,20-0,25; molibden 0,14-0,15; titan aproximativ 0,1.
Metalurgia, cea mai mare ramură a industriei grele, este responsabilă de producția de metale din minereuri și alte materii prime care conțin metale. Metalurgia este veriga centrală a producției miniere și metalurgice, care include geologia, mineritul, concentrarea, metalurgia propriu-zisă, producția de turnătorii și prelucrarea metalelor prin diferite metode (presiune, temperatură, metode mecanice etc.). Metalurgia se bazează pe principiile tehnologiei chimice, deoarece în timpul proceselor metalurgice materialele prelucrate suferă diverse transformări fizice și chimice. Prin urmare, metalurgia este strâns legată de fizică, chimie și în special de chimia fizică, care reprezintă baza științifică a metalurgiei teoretice și practice. În ultimii ani, legătura dintre metalurgie și matematică și informatică a fost în creștere.
Industria metalurgică din Rusia produce în prezent 78 de elemente din sistemul periodic al lui D.I. Mendeleev, precum și diverse tipuri de îngrășăminte, materiale de construcție, acid sulfuric și sulf, ciment și multe alte tipuri de produse. Metalurgia în Rusia este o ramură foarte dezvoltată a producției de materiale. De o importanță deosebită pentru dezvoltarea mineritului și topitoriei în Rusia au fost lucrările lui M. B. Lomonosov, D.I. Mendeleev, precum și a marilor specialiști în producția de metale feroase P.P. Anosov, D.K. Chernov, N.N. Beketov, I.P. Bardin și mulți alții. O contribuție neprețuită la dezvoltarea metalurgiei naționale neferoase a fost adusă de A.A. Baikov, NS. Kurnakov, P.P. Fedotiev, V.A. Vanyukov, AI. Belyaev, I.F. Khudyakov, A.A. Volsky și alții.
Metalele, proprietățile și clasificarea lor
Majoritatea metalelor au o serie de proprietăți care sunt de natură generală și diferă de proprietățile altor compuși simpli sau complecși. Astfel de proprietăți sunt punctele de topire relativ ridicate ale majorității metalelor, capacitatea de a reflecta lumina, conductivitatea termică ridicată și conductivitatea electrică, capacitatea de a se rostogoli. Aceste caracteristici sunt explicate prin existența în metale a unui tip special de legătură — metalică.
Conform poziției lor în sistemul periodic, atomii metalici au un număr mic de electroni de valență și mulți orbitali neocupați. În plus, electronii de valență sunt destul de slab legați de nucleele lor și, prin urmare, au o mare libertate de mișcare în rețeaua cristalină a metalului. imaginea generală a stării metalice poate fi reprezentată în următoarea formă. Nodurile rețelei cristaline a metalului sunt ocupate atât de atomi individuali, cât și de ioni, între care electronii, numiți uneori gaz de electroni, se mișcă relativ liber (fig. 1).
Deoarece electronii de valență sunt distribuiți în cristalul metalic aproape uniform, este imposibil să se vorbească de o direcționalitate a legăturilor metalice. Aceasta este diferența lor importantă față de legăturile ovalente, care au o direcționalitate strictă în spațiu. Legăturile metalice se deosebesc de legăturile covalente și prin rezistența lor: energia lor este de 3-4 ori mai mică decât energia legăturilor covalente. Existența electronilor mobili în cristalul metalelor explică trăsăturile lor caracteristice (conductivitate electrică, conductivitate termică).
Legătura metalică poate fi definită ca un tip de legătură chimică covalentă non-direcțională în care atomii au puțini electroni de valență, mulți orbitali liberi, iar electronii de valență sunt ținuți slab de nucleu
Astfel, metalele sunt elemente chimice ale căror rețele cristaline sunt formate din atomi și ioni, iar electronii se mișcă liber în spațiul dintre nuclee. Legătura dintre atomi este covalentă, iar cea dintre ioni și electroni — metalică.
Atomii pierd constant electroni, transformându-se în ioni, iar aceștia din urmă îi acceptă, devenind atomi. Numărul de electroni care se plimbă aleatoriu în rețeaua cristalină, ca moleculele de gaz, în metale diferite este diferit, determină proporția legăturilor metalice și măsura metalicității elementului.
Ideea rețelei cristaline — „scufundată într-un nor de electroni care rătăcesc liber” — exprimată pentru prima dată în 1902, a fost completată în prezent și a dobândit o interpretare oarecum modificată; cu toate acestea, ea și în forma sa inițială simplificată explică bine conductivitatea electrică ridicată, conductivitatea termică și emisia termoelectronică a metalelor.
Atomii și ionii din nodurile rețelei cristaline sunt supuși unor forțe de atracție și repulsie reciprocă. Amplitudinile vibrațiilor ionilor și atomilor depind de temperatură și cresc cu temperatura. La punctul de topire, amplitudinile vibrațiilor sunt atât de mari încât rețeaua se prăbușește: atomii și ionii își pierd locurile permanente și intră în mișcare dezordonată, caracteristică stării lichide. Legătura dintre ioni și electroni se numește metalică, iar dintre atomi — covalentă. Raportul dintre aceste tipuri de legături chimice determină numărul de electroni rătăciți. Cu cât acest număr este mai mare, cu atât sunt mai pronunțate proprietățile metalice ale elementelor.
Rezistența legăturii metalice explică multe dintre proprietățile fizice și mecanice ale metalelor.
Efectele mecanice externe asupra metalului determină o deplasare a straturilor rețelei cristaline, dar legătura dintre ioni și electroni nu este ruptă datorită mobilității libere a electronilor. Din acest motiv, metalele sunt puternice și maleabile, își schimbă forma, dar nu își pierd rezistența. Cuprul și aurul au mulți electroni liberi, legătura metalică predomină mult asupra legăturii covalente — aceste metale sunt maleabile, maleabile, ductile. Antimoniul și bismutul au relativ puțini electroni liberi, deci sunt fragile.
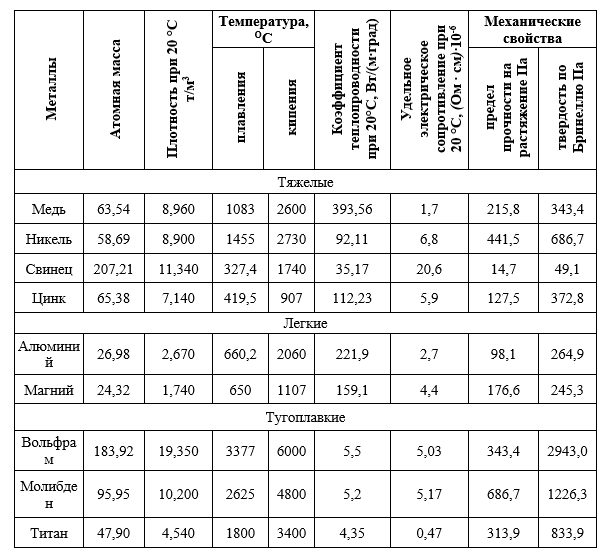
Sunt prezentate unele proprietăți fizice și mecanice ale celor mai comune metale neferoase (tabelul 1).
Conductivitatea electrică datorată mișcării în spațiul rețelei cristaline a electronilor „generalizați” depinde în mod evident de libertatea de mișcare a acestora — corectitudinea aranjării atomilor, amplitudinea și frecvența oscilației lor termice. Într-adevăr, odată cu creșterea temperaturii, gama de vibrații a nodurilor rețelei crește, dispersia electronilor crește, iar conductivitatea electrică scade; odată cu răcirea, aceasta crește din nou. La temperaturi apropiate de zero absolut, rezistența electrică a anumitor metale și aliaje devine extrem de mică. Necesitatea unor temperaturi foarte scăzute împiedică încă utilizarea practică a acestui fenomen valoros și interesant. Superconductibilitatea la minus 253 °C, descoperită la mijlocul secolului XX într-un aliaj de niobiu, aluminiu și germaniu, — un fenomen rar. Un alt astfel de supraconductor „de înaltă temperatură” este un aliaj de niobiu și galiu.
Prezența unor impurități, chiar mici, din alte elemente reduce conductivitatea electrică: perturbând ordinea în rețea, acestea împrăștie electronii. Atomii deplasați ca urmare a unei acțiuni mecanice externe — deformare prin forjare, laminare sau alte prelucrări similare — împrăștie de asemenea electroni.
Conductivitatea termică variază aproape întotdeauna în funcție de temperatură într-un mod similar conductivității electrice — metalele cele mai conductoare electric conduc bine căldura, în timp ce cele cu rezistență electrică relativ ridicată o conduc mai rău. Conductivitatea termică este legată atât de vibrațiile atomilor din rețea, cât și de mișcarea electronilor liberi. Acesta din urmă pare să aibă o importanță predominantă.
Proprietățile mecanice — rezistența la tracțiune, compresiune, încovoiere, duritate și plasticitate sunt explicate nu numai prin legătura metalică, ci și prin particularitățile structurii cristaline a metalelor, având în majoritate rețele spațiale dens compacte cu un număr mare de coordonate. Cele mai tipice dintre acestea sunt prezentate (fig. 2), care trebuie înțelese doar ca o schemă de dispunere a centrelor atomice. În realitate, atomii, reprezentați în mod convențional ca sfere, sunt dens compactați și ocupă doar 70 % din volum (a se vedea Fig. 2 d, 1).
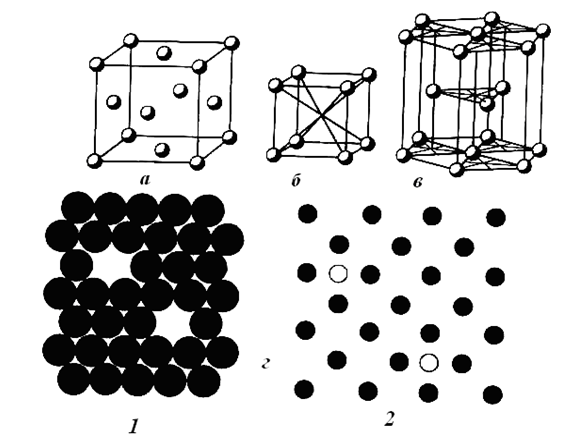
Multe metale sunt solubile între ele în stare lichidă sau solidă sau formează compuși chimici intermetalici, rezultând sisteme cristaline diferite și proprietăți foarte variate. Este vorba despre aliaje, care deschid calea obținerii de noi materiale valoroase cu proprietăți speciale. Sunt deja utilizate mii de aliaje duble, triple și mai complexe, care sunt obținute nu numai prin amestecarea metalelor lichide, ci și prin sinterizarea pulberilor sau dizolvarea unui element în stratul superficial al unui metal solid (aliaj).
Capacitatea de deformare elastică și plastică, conductivitatea electrică și termică ridicată și alte câteva caracteristici alcătuiesc un set de proprietăți care nu sunt inerente altor solide — lemn, piatră, materiale plastice. Aceasta explică recunoașterea incontestabilă a metalelor și aliajelor ca fiind cele mai importante materiale ale tehnologiei moderne.
М. V. Lomonosov a definit metalele ca „…corpuri ușoare care pot fi forjate”. În zilele noastre, pe lângă completarea acestui lucru cu atributele de conductivitate electrică și conductivitate termică ridicată, ar trebui să remarcăm, de asemenea, dependența multor proprietăți de puritate și de prelucrarea mecanică. Același metal poate fi atât maleabil, cât și fragil. În cristalele reale există întotdeauna diverse defecte, din cauza cărora proprietățile mecanice și alte proprietăți fizice nu pot fi atribuite numai caracteristicilor legăturii metalice și rețelei cristaline.
Defectele punctiforme — noduri de rețea neocupate, goluri (vezi figura 2), precum și noduri ocupate de atomi de impurități, apar în timpul cristalizării din topitură. Defecte liniare și plate — dislocațiile se obțin, de asemenea, în timpul cristalizării sau ca urmare a prelucrării mecanice, sub forma unor straturi incomplete de atomi sau a deplasării lor reciproce și uneori a întrepătrunderii.
Numărul total de defecte pe 1 cm 2 de suprafață a unui metal sau aliaj depășește adesea 10 6 . Defectele punctiforme reduc în principal conductivitatea electrică și conductivitatea termică, în timp ce altele reduc și proprietățile mecanice.
Metalele și aliajele obișnuite sunt policristaline, sunt formate din agregate de grăunți orientați aleatoriu. în fiecare grăunte, cristalele elementare au aceeași orientare, iar în cele vecine — o orientare diferită, uneori situate la unghiuri mari (fig. 3). Impuritățile se acumulează la granițele granulelor și se formează goluri de gaz. În plus față de proprietățile fizice mai scăzute, există și o rezistență mai scăzută la coroziune.
Posibilitatea deplasării straturilor cristaline de-a lungul direcțiilor dislocațiilor sau a ruperii acestora la limitele grăunților reduce rezistența. Rezistența crește într-o anumită măsură după recoacere — încălzire și răcire lentă, când dislocațiile sunt parțial eliminate ca urmare a difuziei, iar grăunții devin mai fini.
Prelucrarea provoacă uneori o întărire din cauza întrepătrunderii dislocațiilor. O altă cauză a întăririi semnificative, însoțită de reducerea ductilității și fragilității, se datorează apariției sau introducerii de faze străine insolubile, cum ar fi carbura de fier F3C în oțel sau oxizi și nitruri în titan, wolfram, molibden. Granulele acestor compuși împiedică deplasarea reciprocă a straturilor metalice. Purificarea metalelor de impurități îmbunătățește de obicei mult ductilitatea și facilitează prelucrarea.
Metalele lichide se deosebesc de metalele solide prin legăturile relativ mici dintre atomi și ioni, dar aici libertatea de mișcare a electronilor este păstrată, astfel că sunt și conductoare electrice și termice.
Același metal la temperaturi diferite poate avea diferite rețele cristaline. Trecerea de la un sistem la altul modifică distanța dintre noduri și dispunerea lor, această tranziție se reflectă semnificativ în proprietățile modificărilor polimorfe. De exemplu, staniul, cunoscut la temperaturi obișnuite ca un metal plastic strălucitor de singonie tetragonală cu o densitate de 7,29 g/cm 3 (β — modificare), la temperaturi sub 13,2°C și mai ales la supraîncălzire rapidă se transformă într-o pulbere cenușie, cristalizând într-un sistem cubic cu o densitate de 5,85 g/cm 3 (α — modificare). Transformări similare sunt caracteristice multor alte elemente.
Activitatea chimică a metalelor poate fi caracterizată prin poziția lor în seria tensiunilor electrochimice, unde metalele sunt așezate în ordinea creșterii potențialelor electrochimice normale sau de electrod. Cu cât valoarea algebrică a potențialului normal de electrod este mai mare, cu atât puterea de reducere și activitatea chimică a metalului sunt mai mici. În seria de tensiuni, fiecare metal este capabil să deplaseze metalele din dreapta sa din soluții apoase și săruri topite.
Metalele cu potențial electrochimic negativ sunt ușor supuse oxidării, astfel încât acestea se găsesc în natură numai sub formă de compuși chimici: oxizi, halogenuri, precum și sulfuri, silicați și alte săruri. Pe măsură ce potențialul crește și, prin urmare, activitatea chimică scade, starea liberă a metalelor devine din ce în ce mai stabilă. De exemplu, cuprul, argintul și mercurul se găsesc în natură nu numai sub formă de săruri, ci și în stare liberă, în timp ce aurul și platina sunt predominant în stare liberă. Relația dintre potențialele electrozilor și unele proprietăți ale metalelor este prezentată în tabelul 2.
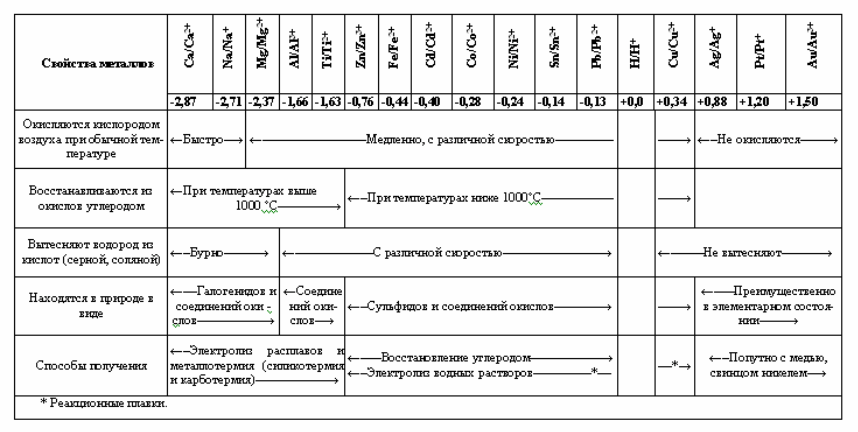
În ceea ce privește caracterizarea metalelor ca elemente chimice, trebuie remarcat faptul că Sistemul Periodic al lui D. I. Mendeleev nu ne permite să le distingem clar de metaloizi și nemetali. Acest lucru este firesc: fiecare element este o unitate dielectrică de proprietăți metalice și metaloide, a căror natură contradictorie nu este eliminată odată cu creșterea sarcinii nucleului și a numărului de învelișuri electronice.
Nemetalele evidente sunt ușor de recunoscut: hidrogenul, gazele nobile, halogenii, elementele din grupa VI — oxigenul, sulful, seleniul, telurul și poloniul, precum și borul, carbonul, azotul, siliciul și fosforul. Toate acestea nu dau oxizi și hidroxizi bazici specifici metalelor. Dintre celelalte elemente, totuși, unele au hidroxizi amfoterici. În special, metale aparent evidente precum zincul și aluminiul au oxizi care prezintă atât proprietăți acide, cât și bazice.
Rețelele cristaline ale metalelor în general au fost discutate mai sus, iar pentru majoritatea elementelor chimice acestea sunt prezentate în mod convențional în tabelul 4. Cu toate acestea, diferența dintre structurile cristaline nu oferă, de asemenea, o bază pentru subdivizarea elementelor care ne interesează. Mercurul și bismutul, care sunt considerate în mod obișnuit metale, cristalizează în sistemul rombic, care nu este specific majorității celorlalte metale, în timp ce indiul și staniul cristalizează în sistemul tetragonal.
Cea mai clară graniță convențională între metale și metaloizi poate fi trasată prin compararea conductivității electrice sau a valorii inverse a acesteia — rezistența electrică specifică. Pentru un metal explicit — nichelul, rezistența electrică specifică este de 6,8∙1 0-6 (Ohm∙cm), iar pentru metaloidul carbon numai în modificarea grafitului este de 1375∙1 0-6 (Ohm∙cm ).
Pe această bază, 80 de elemente ar trebui clasificate ca metale, iar 23 ca nemetale și metaloide.
Mai mult, limitând domeniul metalurgiei la elementele incluse în scoarța terestră, este necesar să se excludă franciul, technetiul, promethiul și actinidele, începând cu americiul, din cele optzeci, și să se stabilească numărul final de metale la 68 (tab. 3).
Datorită efortului de utilizare complexă a materiilor prime și a producției pe scară largă de aliaje, care includ adesea metaloizi, s-au dezvoltat tradiții conform cărora siliciul, germaniul și uneori și seleniul și telurul, care sunt extrase din materiile prime metalurgice, sunt uneori denumite incorect metale. Împreună cu acest metal tipic, sodiul, este obținut prin industria chimică; legătura strânsă dintre chimie și metalurgie este evidentă din acest lucru. În trecut, metalurgia se deosebea de tehnologia chimică prin utilizarea predominantă a topitoriei la temperaturi înalte; în prezent, această caracteristică se pierde din ce în ce mai mult: alături de pirometalurgia la foc, crește importanța hidrometalurgiei, care extrage metalele din minereuri prin levigare cu soluții apoase de reactivi, urmată de recuperarea prin electroliză sau cimentare.
Sorbția, extracția, precipitarea, coprecipitarea și alte metode de prelucrare chimică sunt utilizate ca procese intermediare pentru a separa și concentra substanțele dizolvate.
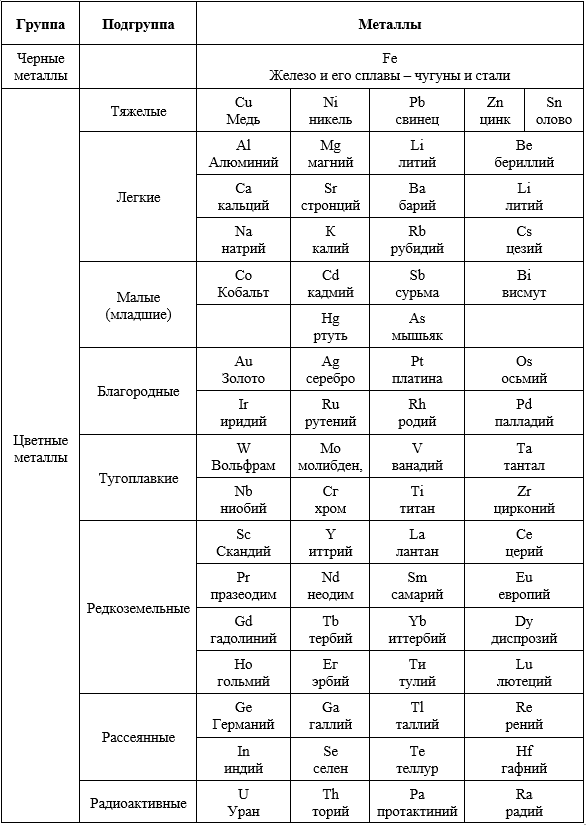
Clasificarea industrială a metalelor, stabilită în mod tradițional în țara noastră în timpul perioadei de industrializare cea mai intensă, nu are o bază științifică clară, dar este utilizată pe scară largă în literatura tehnică și în viața de zi cu zi. Primul său fundament, care este acceptat și în alte țări, constă în diferența netă dintre scara de producție a fierului și a altor metale. În masa totală a producției metalurgice, aliajele de fier ocupă aproximativ 93%. Prin urmare, se face o distincție între „metalele de fier” (fierul și aliajele sale — fontele și oțelurile) și alte „metale altele decât fierul”.
În țara noastră, denumirile convențional acceptate de metale feroase și neferoase corespund acesteia. Metalele neferoase, la rândul lor, sunt subdivizate în funcție de anumite caracteristici generale într-un număr de grupe și subgrupe menționate în tabelele 3 și 4.

În clasificarea de mai sus nu există nici măcar un principiu al denumirii grupelor. De exemplu, la sfârșitul secolului trecut, aluminiul era considerat un metal rar, dar în prezent ocupă primul loc în rândul metalelor neferoase în ceea ce privește producția și consumul. Problema titanului nu a fost rezolvată definitiv, deoarece unii metalurgiști îl încadrează în categoria metalelor rare refractare, iar alții în categoria metalelor ușoare. Prin urmare, diferiți metalurgiști, aderând la diferite puncte de vedere, referă metalele individuale la diferite grupuri.