Una dintre primele diagrame de stare ale sistemului Mn — N, construită de M. Hansen și Anderko, pe baza rezultatelor studiilor din anii 40 și 40. Hansen și K. Anderko pe baza rezultatelor studiilor din anii 30-40, este prezentată în Fig. 16.1. Azotul formează soluții solide în fiecare modificare alotropică a manganului, deși solubilitatea sa în aceste forme de mangan este diferită. Soluțiile pe bază de γ-Mn ocupă cea mai mare regiune de concentrație din diagramă. Domeniile de existență ale soluțiilor solide bazate pe alte modificări sunt semnificativ mai mici. Se crede că azotul, dizolvându-se în γ-Mn, crește temperatura de topire a manganului la aproximativ 1300 °С. La atingerea acestei temperaturi, soluția solidă γ eliberează azot și, așa cum rezultă din diagrama de mai sus, temperatura de topire scade brusc.
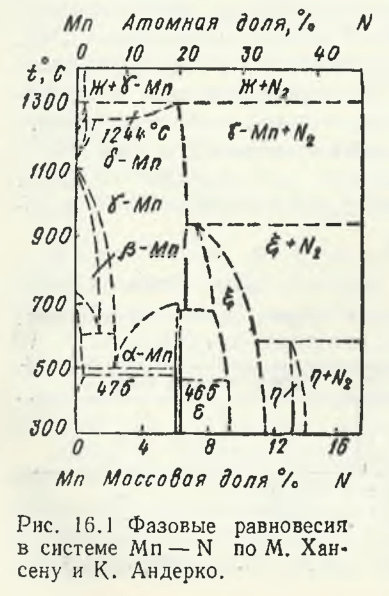
În plus față de zonele de existență a soluțiilor solide de azot în toate modificările alotropice ale manganului, diagrama prezentată Fig. 16.1 a prezentat existența a trei faze nitride: fazele ε-, ξ- și η-, cărora cercetătorii le atribuie diferite formule de nitruri, Faza ε (Mn4N) are o regiune îngustă de omogenitate (de la 20,0 la 21,4 % (mol.) N). Limitele de existență ale fazei ξ (Mn5N2+ MnN) trec pe partea de mangan de la 28 % (mol.) la 540 °C la 24,7 % (mol.) N la 750 °C, ceea ce a fost acceptat anterior ca o tranziție continuă de la rețeaua HCC a fazei ε la rețeaua hexagonală a fazei ξ. Autorii estimează că transformarea cristalochimică ε-fază → ξ-fază este puțin probabilă, astfel încât Fig. 16.1 prezintă două regiuni de fază. Inițial, fazei ξ i s-a atribuit compoziția Mn5N2 (9,25 % (wt.) N) cu o regiune de omogenitate largă. La 400 °C, conținutul minim de azot este de 28,4 % (mol.) N (9,2 % (wt.), N) și maximul este de 34,6 % (mol.) N (11,9 % (may.) N). Se consideră că faza ξ include compoziții de Mn5N2 și Mn2N. Regiunea fazei ξ este cuneiformă la 940 °C. Existența fazei η în diagramă (fig. 16.1) este atribuită intervalului de concentrație a azotului de la 38,0 la 39,0 % (mol.) N (13,5-14 % (greutate) N). Aceasta este faza nitrură de mangan cea mai bogată în azot și, în același timp, cea mai puțin stabilă termic. La temperaturi >580 °C, faza η se disproporționează în faza ξ și azot molecular.
După anii ’40 și până în prezent, diagrama de stare a Mn — N și problemele de clarificare a compoziției fazei sale și a zonelor de existență a acesteia din urmă la temperatură-concentrație au fost constant în câmpul de vedere al cercetătorilor. Acest lucru se explică prin necesitatea de a acumula noi cunoștințe științifice despre interacțiunea în sistemul Mn — N și de a le utiliza pe scară largă pentru crearea de noi procese și îmbunătățirea celor existente pentru producția de oțeluri nitrurate cu mangan, crom-mangan cu conținut de azot și altele. Manualul lui R. P. Elliot, care a fost publicat ceva mai târziu decât manualul, rezumă rezultatele noilor cercetări privind studiul echilibrelor de fază în sistemul Mn — N. Un element esențial de noutate, remarcat de R. P. Elliot, este indicarea delimitării incorecte a regiunii de soluție solidă pe baza γ-Mn. La 800 ° C, potrivit lui R. P. Elliot, ar trebui să existe o regiune bifazică. R. P. Elliott consideră că datele privind poziția limitelor de fază prezentate în tabelul 16.1 sunt mai fiabile.

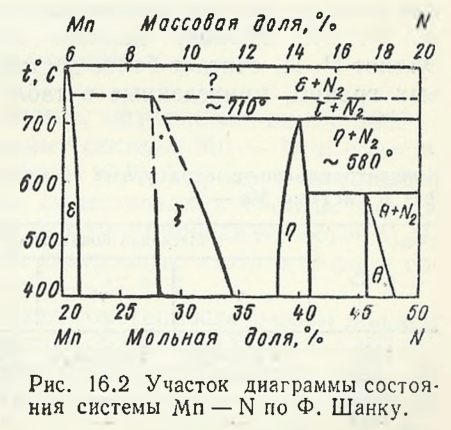
Shank F., rezumând noile date publicate în 1962 — 1964, a prezentat o diagramă parțială a sistemului Mn — N în regiunea de concentrație de la 20 la 50 % (mol.) N (fig. 16.2). Împreună cu valorile cunoscute ε1— , fazele ε- și η-, este trasată regiunea de existență a fazei θ. Samsonov G.V. a etichetat faza θ ca fază ν, atribuindu-i compoziția Mn6N5(Fig. 16.3). La 400 °C, conținutul minim de azot al fazei θ este de 45,7 % (mol.), iar cel maxim este de 47,9 %.
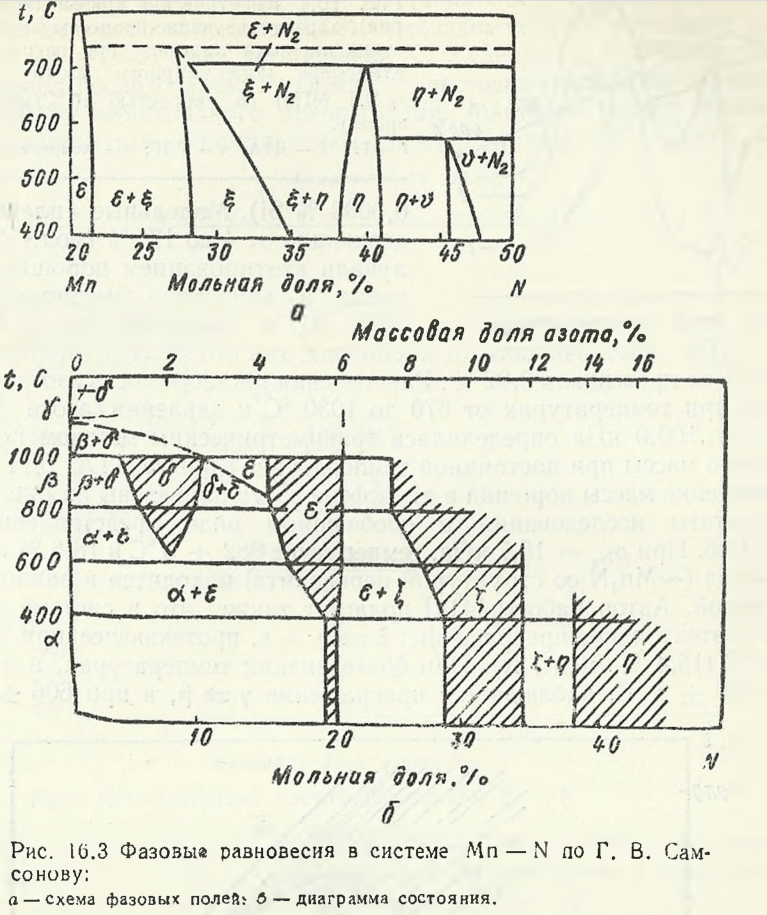
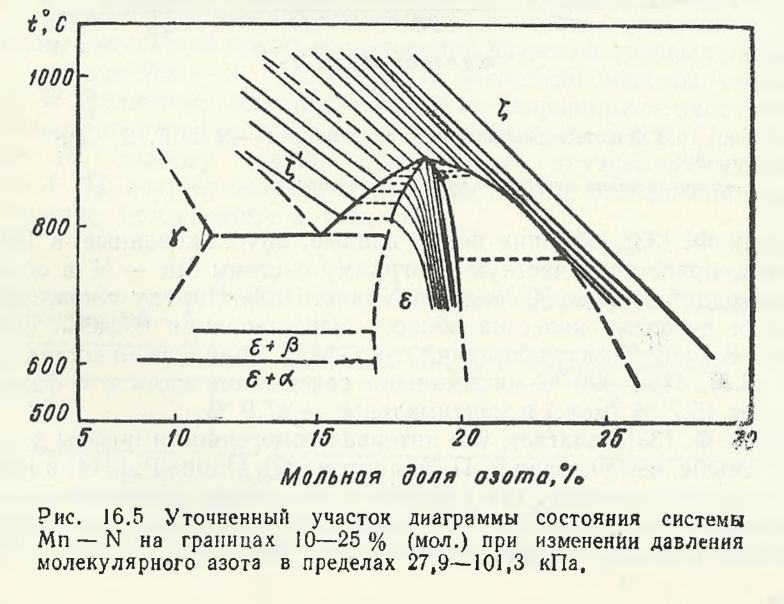
Shank F. sugerează că intervalul de omogenitate al fazei η ar trebui să fie mai mic decât cel dat de R. P. Elliott. Pompe R. a efectuat în 1979 studii pentru clarificarea diagramei de stare Mn — N în intervalul de 10-25 % (mol.) N. În experimente a fost utilizată pulbere de mangan de înaltă puritate (99,9 % Mn; Mg 0,004; 0,0005 % Fe; 0,0002 % Si). Aliajele model conținând de la 4 la 17 % (mol.) N au fost obținute prin nitrurarea pulberii de mangan în atmosferă de azot molecular la temperaturi de până la 1050 °C și presiune pN2 = 27,9…101,3 kPa. Azotul a fost purificat de oxigen astfel încât concentrația sa masică să nu depășească 0,02 %. Solubilitatea de echilibru a azotului în mangan la temperaturi cuprinse între 670 și 1030 °C și presiunea azotului pN2= 0,46… 100,0 kPa a fost determinată prin metoda gravimetrică prin creșterea masei la temperatură constantă. Curbele DTA, DTG și TG și modificarea masei pulberii în atmosferă de azot sunt prezentate în Fig. 16.4. Rezultatele studiului sunt rezumate în Fig. 16.5.

La pN2 = 15,7 kPa, temperatura 882 ± 3 °C și 18,6 % (mol.) N ε-fază (~Mn4N cu structură perovskită) este în echilibru cu faza ξ. De asemenea, autorul consideră că sistemul are o transformare eutectoidă: ξ ⇔ γ + ε, care are loc la 782 ± 3 °C (15,4 % (mol.) N). La temperaturi mai scăzute, mai precis la 640 ± 5 °C, se observă transformarea γ ⇔ β, iar la 606 ± 3 °C are loc transformarea β ⇔ φ. Instabilitatea fazei ξ la 3 . Azidele metalice sunt instabile și sub frecare, impact și lumină se descompun cu explozie.
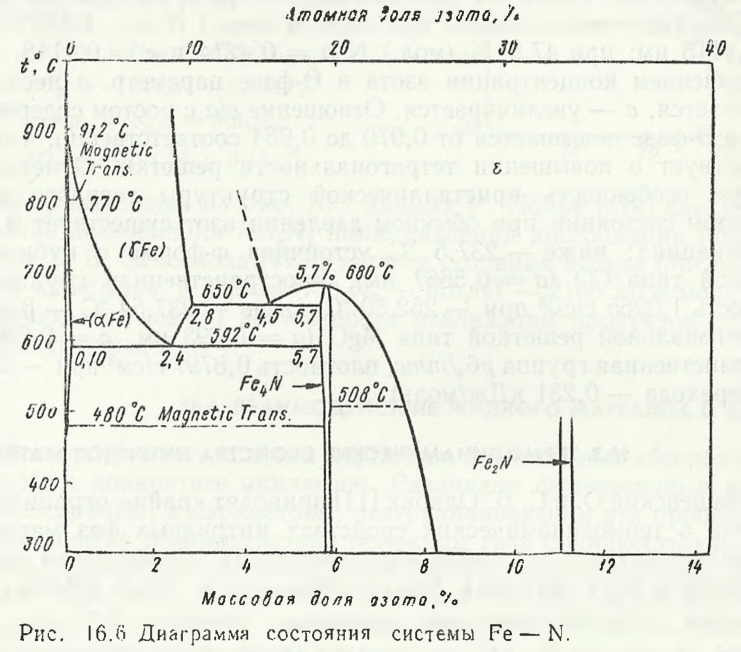
În timpul nitrurării ferromanganului, azotul interacționează cu atomii de fier împreună cu manganul. În sistemul binar Fe — N (fig. 16.6) se formează nitrurile Fe4N și Fe2N, precum și soluții solide bazate în principal pe γ-Fe. Deoarece concentrația de fier în feroaliajele de mangan este mică (până la 15 %), trebuie presupus că fazele nitride din sistemul Mn- Fe — N se formează pe bază de mangan.
Interacțiunea manganului lichid cu azotul
Absorbția azotului de către manganul lichid este un proces de absorbție, mai precis de ocluzie. Se face o distincție între absorbția fizică și chimică, iar parametrul care diferențiază aceste procese este energia de interacțiune a moleculei de gaz cu lichidul și, aparent, cu metalul topit. Dacă energia de interacțiune a unei molecule ≤20 kJ/mol, un astfel de proces se referă la absorbția fizică, dacă >25 kJ/mol — la absorbția chimică. Procesele însoțite de o schimbare de energie între 20-25 kJ/mol sunt considerate intermediare.
În lucrările cunoscute, problemele de termodinamică a interacțiunii manganului cu azotul sunt limitate la analiza funcțiilor termodinamice în ceea ce privește fazele solide de nitrură. Termodinamica și cinetica proceselor de absorbție în sistemul de mangan lichid pur — azot molecular sunt luate în considerare în studii unice. De regulă, în primele studii (de la primele lucrări ale lui I. I. Zhukov (1908) și (1926) și inclusiv studiile experimentale efectuate în anii 50-60) problema a fost redusă la stabilirea dependenței experimentale a solubilității azotului molecular în manganul lichid de temperatură și presiune, din cauza purității diferite a manganului utilizat în experimente și a metodelor de experimentare a relațiilor cantitative [N]Mn(T, p) obținute de diferiți autori diferă semnificativ.
Studiile experimentale privind solubilitatea azotului în manganul lichid pur au fost întreprinse încă de la sfârșitul secolului al XIX-lea. Lucrări cunoscute în acest domeniu I. I. Zhukov (1908), N. E. Goken a determinat experimental funcția[N]Mn (T), care are forma lg[N]Mn = 3090/T — 1,55 [% (mol.)]; ΔGT = -53,989 + 27,08T, J/mol. Potrivit lui I.B. Baratashvili, solubilitatea azotului molecular în mangan lichid [% (mol.)] la diferite temperaturi și presiune pN2 = 0,1 MPa este descrisă de expresiile
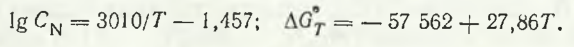
В. P. Perepelkin a stabilit experimental că solubilitatea azotului în manganul lichid la o presiune de 101 kPa este de 2,5 % la 1300 °C și scade la 1,6 % la 1500 °C.
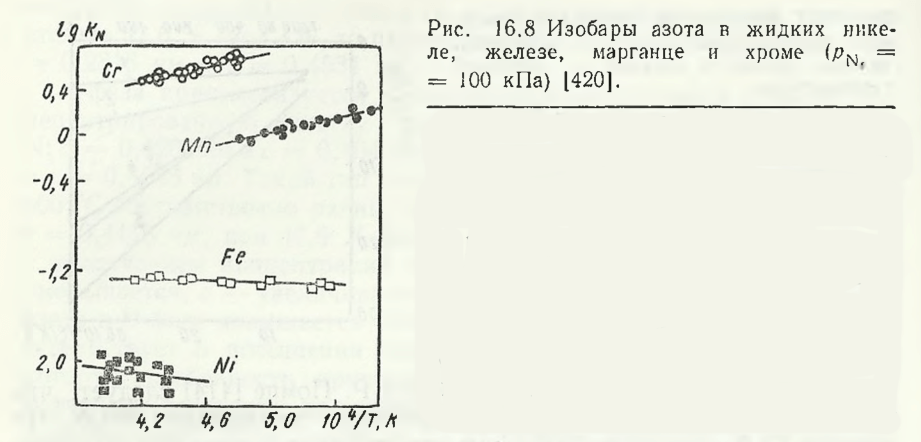
G. M. Grigorenko și Y. M. Pomarin au generalizat rezultatele studiului solubilității azotului în manganul lichid și în alte metale 3d (Cr, Fe, Ni). Dependența de temperatură a solubilității azotului lg KN în topiturile acestor metale sunt prezentate în Fig. 16.8, iar constantele termodinamice ale acestui proces la pN2 = 100 kPa — în tabelul 16.2. Căldurile de dizolvare a azotului în manganul și cromul lichid au o valoare pozitivă, iar pentru fier și nichel — negativă.

În topiturile din sistemul Mn — Fe, solubilitatea azotului la pN2= 100 kPa crește odată cu creșterea concentrației de mangan, iar entalpia de dizolvare în intervalul 3-8 % Mn își schimbă semnul (de la plus la minus) (tabelul 16.3).
Datele experimentale ale dependenței de temperatură a solubilității azotului în întreaga gamă de compoziții ale topiturilor sistemului mangan-fier sunt descrise de expresia
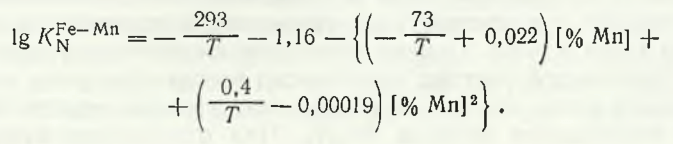
Burylev B.P. a propus pentru calculul solubilității azotului în topiturile sistemului Mn — Fe expresia
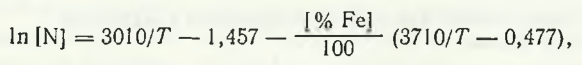
unde [% Fe]- concentrația masică de fier în topitura Mn — Fe. Calculul prin această formulă pentru aliajul 80 % Mn — 20 % Fe la 1500 ° C dă o valoare a solubilității egală cu ~0,8 % N.