Metalele nobile se deosebesc de alte elemente cunoscute de popoarele antice prin invariabilitatea lor în aer, dificultatea extracției și valoarea ridicată. În prezent, ele sunt numite și prețioase, deși unele elemente refractare sunt încă mai scumpe decât aurul și platina.
Aurul și argintul erau cunoscute cu mult înainte de începutul erei noastre. Egiptenii exploatau zăcămintele aurifere din Nubia (Africa de Est). Fenicienii au descoperit acolo țara Ophir, bogată în aur, știau despre numeroase zăcăminte de aur și argint din Armenia, Spania și Cipru.
Primele informații fiabile despre metalurgia antică a metalelor prețioase datează încă din istoria Greciei antice — 40-50 de secole î.Hr.
Prima utilizare a aurului (Au) și a argintului (Ag) a fost pentru fabricarea bijuteriilor și a ustensilelor, iar odată cu dezvoltarea schimbului — a monedelor. Până la sfârșitul secolului trecut și, în unele locuri, chiar și astăzi, aceste metale au servit ca material monetar în multe țări, iar apoi au dobândit funcția de echivalent bursier al bancnotelor.
În 1738, matematicianul spaniol Don Antony de Ulloa a descoperit platina (Pt) — „aurul alb” — în timpul unei călătorii în America de Sud, considerată inițial un aliaj de aur și argint. În literatura secolului al XVIII-lea era numit aur „putred” sau „broască”, evaluat la jumătate din prețul argintului și uneori adăugat la monedele de aur pentru contrafacere. Abia în 1752, după cercetările lui Schaeffer, platina a fost recunoscută ca element nou.
În 1803. Wollaston, tratând pepite de platină cu vodcă regală, a descoperit alte două metale nobile în soluție, paladiu (Pd) și rodiu (Rh). La scurt timp (1803 — 1804), Smithson Tennant a descoperit osmiu (Os) și iridiu (Ir) în reziduul insolubil rezultat în urma unui tratament similar al platinei. Ruteniul (Ru) a fost descoperit în 1844 de C. C. Klaus în zăcămintele de platină din Ural și denumit Rhutenia (latină) în onoarea Rusiei.
Este interesant de observat originea numelor altor platinoide: platina corespunde spaniolului plata — argint, rodiul grecescului rhodos, marcând culoarea roz a soluțiilor. Palladium este numit după descoperirea asteroidului Palladus, iar iridium provine din grecescul iris, adoptat datorită diferenței de colorare a ionilor.
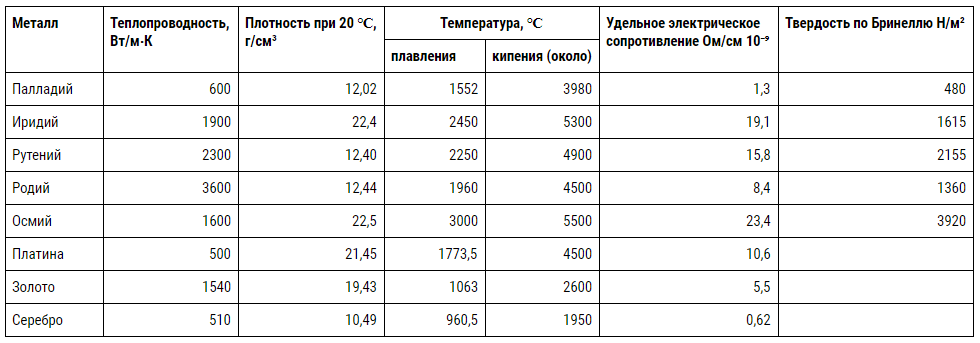
Unele proprietăți fizice și mecanice ale platinoidelor sunt colectate în tabelul 23, familiarizarea cu care este necesar să se acorde atenție punctelor de topire ridicate ale metalelor și durității lor, aproape, de exemplu, la iridiu, osmiu și ruteniu de oțelul călit. În același timp, aurul și platina sunt caracterizate de moliciune, maleabilitate și ductilitate. Proprietățile chimice sunt discutate mai jos.
Odată cu dezvoltarea industriei, metalele nobile și-au găsit o aplicare tehnică mai largă.
Importanța modernă a metalelor nobile
Aurul, care continuă să fie un echivalent monetar, este inclus în numeroase aliaje cu argint, platină, cupru, nichel, staniu, inclusiv cele utilizate în străinătate la instalarea motoarelor cu reacție, rachetelor și reactoarelor nucleare. Metalul pur, cu reflectivitatea sa ridicată și rezistența la coroziune, poate servi ca o acoperire excelentă care reflectă bine lumina. Se știe că primii sateliți americani au fost acoperiți cu un strat de aur gros de câteva miimi sau sutimi de micrometru. Utilizarea metalului pentru proteze dentare scade treptat: au fost dezvoltate mai multe aliaje de substituție în acest scop; cu toate acestea, ele sunt încă mai puțin atractive.
Argintul a intrat în uz industrial odată cu inventarea fotografiei și, ulterior, odată cu utilizarea pe scară largă a cinematografiei, radiografiei, producției de baterii alcaline și energiei nucleare. Cererea industriei de argint a depășit de mult timp capacitatea de topire, iar acest deficit încearcă să fie completat cu metale secundare prin reciclarea monedelor vechi, a resturilor de oglinzi, a bijuteriilor și a filmelor foto uzate.
Pentru o lungă perioadă de timp, platina nu a putut fi purificată de impuritățile care îi reduceau ductilitatea. În anii ’70 ai secolului al XVIII-lea au fost fabricate pentru prima dată produse tehnice din metal pur: plăci, creuzete, sârmă; acestea erau apreciate datorită rezistenței lor la acizii puternici concentrați. La începutul secolului al XIX-lea au început să se fabrice vase de platină pentru obținerea acidului sulfuric, care cântăreau mai mult de 10 kg. Cu toate acestea, până la mijlocul aceluiași secol, în unele țări platina a fost utilizată pentru monede și bijuterii. După cel de-al Doilea Război Mondial, consumul de platină în bijuterii și medicină, care anterior reprezenta aproximativ 60 % din producția totală, a scăzut la 8-10 %. În același timp, cererea de platinoide ca înlocuitori ai platinei a crescut puternic. Platina, paladiul și aliajele de platină cu paladiu, rodiu, iridiu, ruteniu, precum și aliajele de platină și paladiu cu metale comune servesc drept catalizatori în tehnologia anorganică și organică, sub formă de plasă, burete, sârmă, staniu și pulbere fină. Acestea sunt utilizate în sinteza amoniacului din azot și hidrogen, pentru hidrogenarea și dehidrogenarea substanțelor organice, reducerea compușilor nitro și a halogenurilor, în producția de acizi sulfuric și cianhidric.
În industria petrolieră, catalizatorii metalici din platină sunt necesari pentru producerea de combustibili cu cifră octanică ridicată și a unui număr de produse sintetice. Osmiul este utilizat în hidrogenarea unor compuși organici. De asemenea, paladiul este utilizat pentru purificarea hidrogenului și a deuteriului.
În electrotehnică, electronică și instrumentație, platina, platinoidele și diversele lor aliaje sunt utilizate în asamblarea echipamentelor de comunicații, pentru piesele instrumentelor astronomice și electrozii tuburilor cu raze X. Termocuplurile din platină și din aliajele sale cu rodiu sunt adecvate pentru măsurarea pe termen lung a temperaturilor ridicate; limitele posibile ale acestora se extind odată cu creșterea procentului de rodiu din aliaje, care este mai puțin volatil. Acoperirile de rodiu, foarte reflectorizante, sunt importante pentru tehnologia proiectoarelor și nu își pierd proprietățile până la 400 °C. Aliajele foarte dure de osmiu cu iridiu sunt utilizate pentru fabricarea instrumentelor de măsură de precizie — astronomice și nautice. Înlocuirea platinei cu platinoide este adesea favorabilă: paladiul și ruteniul sunt mai ieftine decât platina.
Iridiul este de aproximativ cinci ori mai scump decât aurul; prin urmare, utilizarea sa în formă pură este încă redusă. Creuzetele realizate din acest metal sunt adecvate pentru experimente la temperaturi de până la 2300 °C. Acoperiri electrolitice și chimice foarte rezistente de iridiu pe metale și ceramică cu o grosime mai mică de 0,1 mm. Izotopul radioactiv Ir 192 cu un timp de înjumătățire de 74,5 zile, produs în reactoarele atomice, este utilizat pentru defectoscopia gamma și ca senzor de nivel pentru materialele în vrac.
Osmiul este, de asemenea, foarte scump — de cel puțin 30 de ori mai scump decât aurul. Acesta are un efect catalitic mai puternic decât platina în unele reacții de hidrogenare a substanțelor organice. În ciuda costului său ridicat, compușii de osmiu sunt utilizați pentru a produce o vopsea neagră specială pentru vopsirea porțelanului.
Proprietățile metalelor nobile
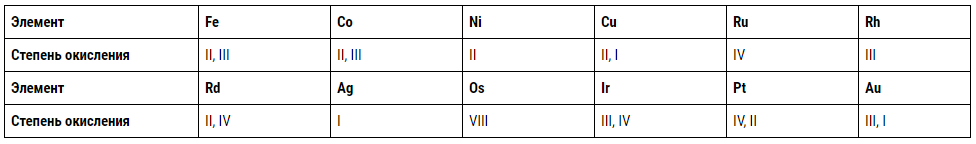
În ciuda diversității proprietăților, metalele nobile prezintă unele asemănări. În primul rând, toate sunt elemente de tranziție din perioadele V și VI, unde sunt dispuse în rânduri consecutive de la #44 la 47 și de la #76 la 79. În ceea ce privește plasarea în grupele Sistemului Periodic, ruteniul și osmiul sunt similare cu fierul, paladiul și platina — cu nichelul, rodiul și iridiul — cu cobaltul, iar aurul și argintul — cu cuprul.
Structura atomilor elementelor de tranziție diferă în ceea ce privește sarcina nucleului, numărul de electroni d și electronii s externi. Aceștia din urmă sunt relativ neimportanți din cauza formării predominante a compușilor complecși ai metalelor nobile și a unui număr mic de săruri simple. Pe măsură ce orbitalii d sunt ocupați, gradul de oxidare cel mai tipic, indicat mai jos cu cifre romane, scade, iar cu creșterea numărului de ordine în grupe crește:
Osmiul este oxidat de oxigenul din aer la temperaturi obișnuite la OsO4iar iridiul, ruteniul și paladiul numai într-o formă fin dispersată și destul de rapid numai atunci când sunt încălzite.
Alte metale nobile nu sunt oxidate nici măcar de oxigenul pur. Oxizi: Ag2O, Au2O3Rh2O3Ir2O3PtO2 etc. pot fi obținute numai indirect — prin transformarea altor compuși chimici ai acestor elemente.
Argintul și paladiul sunt dizolvate în acid nitric. Aurul și platina sunt oxidate de vodca regală, care acționează numai foarte lent asupra iridiumului, rodiului și ruteniului; de asemenea, transformă paladiul în soluție și argintul într-o clorură solidă. Vodca de țar nu are niciun efect asupra osmiului și ruteniului.
Rodiul este oxidat de acidul sulfuric concentrat și fierbinte, formând sulfatul Rh2(SO4)3De asemenea, reacționează cu topiturile de sulfați acizi de sodiu și potasiu.
Osmiul și ruteniul sunt transformate în soluții prin aliere cu oxizi de sodiu (II) sau bariu (IV) (Na2O2BaO2) sau prin fuziune cu o substanță alcalină și un agent oxidant, de exemplu NaOH și NaClO3. Aliajele sau aliajele sinterizate sunt solubile în apă.
Ruteniul (II), rodiul (III) și paladiul (II) formează ioni simpli numai în soluții de perclorat, iar argintul în soluții de sulfat, nitrat, acetat și alte câteva soluții. Alte metale nobile formează în soluții apoase numai cationi și anioni complecși, ale căror proprietăți redox depind în mare măsură de rezistența legăturii cu ligandul. Potențialele ionilor simpli de metale nobile care se găsesc adesea în literatura de specialitate sunt obținute prin calcul și nu au întotdeauna o semnificație fizică reală, deși pot fi utilizate ca constante termodinamice.