Tipurile de sisteme sunt de obicei clasificate în sisteme omogene sau cu o singură fază și sisteme eterogene care conțin mai multe faze. O fază este o parte a unui sistem care are o compoziție omogenă, proprietăți fizice și chimice similare în absența influențelor externe. În volumul sistemului, faza poate fi prezentă într-o zonă închisă sau împărțită în mai multe părți.
În același timp, „faza” și „starea agregată a materiei” nu sunt analoge, deoarece un sistem poate avea faze în aceeași stare agregată. Într-un sistem în echilibru, numărul de faze este fix, dar se poate modifica prin încălzire.
Ce sunt fazele Gibbs

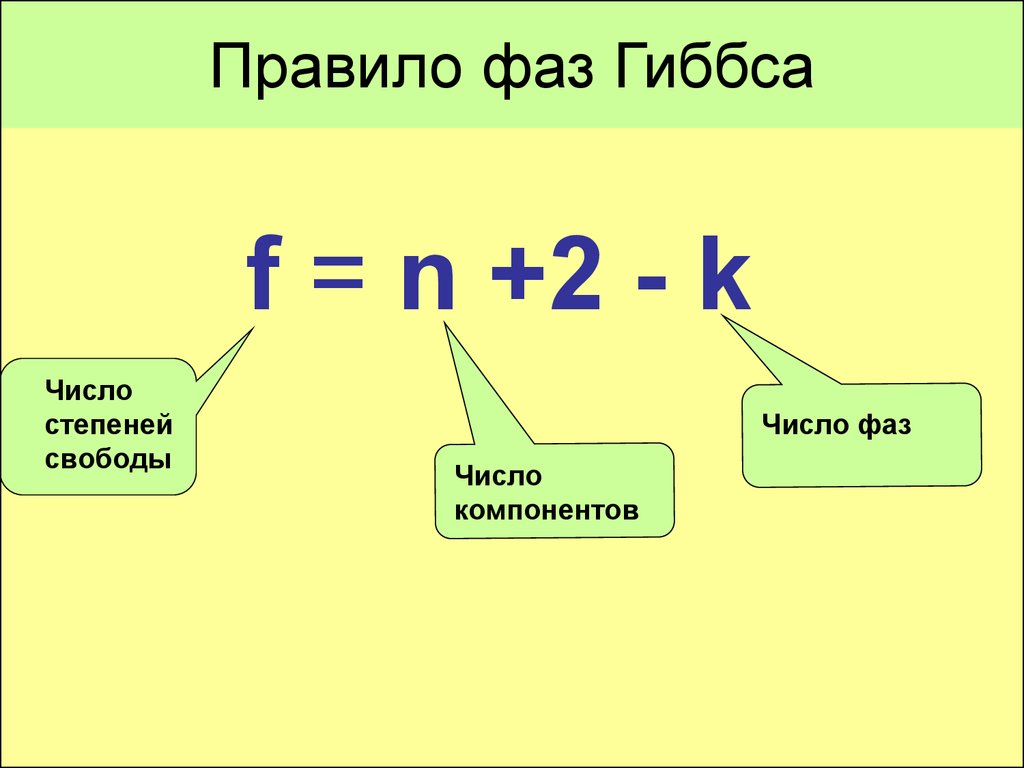
Legea de bază a echilibrului fazelor sau regulile de fază Gibbs definește relația dintre numărul de faze din sistem F, componentele K, gradele de libertate C. Aceasta reflectă variațiile posibile ale factorilor externi, cum ar fi:
- presiunea;
- temperatura;
- compoziția fazelor — fără a modifica numărul de faze din sistem și este exprimată prin formula: C = K — F + n, unde n este definit ca numărul de influențe externe care afectează indicele de echilibru al sistemului.
Luând în considerare aliajele aflate sub influența condițiilor atmosferice, de regulă, rămâne unul singur, factorul de temperatură, în legătură cu care ecuația se transformă și arată după cum urmează:
C este suma mai multor variabile independente care descriu starea sistemului.
De exemplu, să luăm un metal pur. În timpul procesului de topire, numărul de faze din acesta este de două — topitura și cristalele, componentele sunt 1, iar gradele de libertate sunt 0. În consecință, în această perioadă este imposibil să influențăm factorii externi (în cazul nostru este temperatura) și să îi modificăm fără a schimba numărul de faze din sistem. La creșterea temperaturii, vom obține o fază — topitură, la scădere, tot o fază — cristale. Conform regulii fazei Gibbs, rezultă că un sistem monocomponent menține echilibrul a două faze, iar un sistem bicomponent menține echilibrul a trei faze.
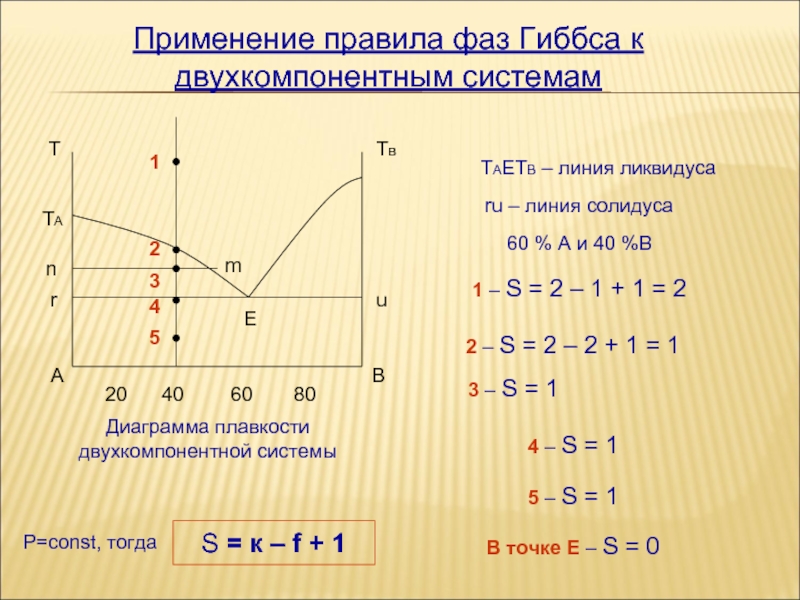
Construcția diagramelor de stare
Regula fazei Gibbs și aplicarea sa sunt relevante într-o serie de industrii, inclusiv în metalurgie, unde este utilizată în construirea curbelor de încălzire și răcire a metalelor în procesul de topire. Una dintre modalitățile de creare a diagramelor de stare este fixarea curbelor de răcire în raport cu temperatura și timpul mediului în timpul răcirii sale line. În acest caz, punctele de inflexiune marcate pe curbele de răcire din diagramă sunt similare cu punctele de transformare a compoziției fazelor.

Diagrama este construită în coordonate:
- compoziția (în procente A și B);
- temperatura în grade Celsius.
Adică, fiecare punct fixat pe diagramă arată în ce stare se află aliajul cu o anumită compoziție atunci când este expus la o anumită temperatură. Luând în considerare principalele tipuri de diagrame, puteți vedea următorul model: solubilitatea în fiecare alte componente care sunt în stare lichidă nu este limitată.
Astfel, în conformitate cu regula Gibbs în știința materialelor, atunci când parametrii de stare ai mediului sunt limitați, numărul de grade de libertate este redus în conformitate cu numărul de limitări.