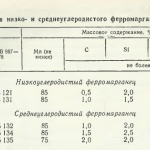
Manganul este un metal destul de comun, de culoare neagră, cu o greutate atomică de 25. Se găsește adesea în natură, de exemplu, conținutul său în scoarța terestră este de 0,1%. În ceea ce privește prevalența, acesta ocupă locul 12 între toate celelalte elemente. În plus, metalul este considerat una dintre cele mai importante resurse minerale din lume. Este esențial și indispensabil în fabricarea oțelului, deoarece ajută la transformarea fierului în oțel.
În ceea ce privește proprietățile sale, Mn este implicat în reacțiile chimice redox și este, de asemenea, un element esențial, astfel încât este utilizat pe scară largă pentru reacțiile cu oxigenul.
Particularități ale reacției dintre mangan și oxigen

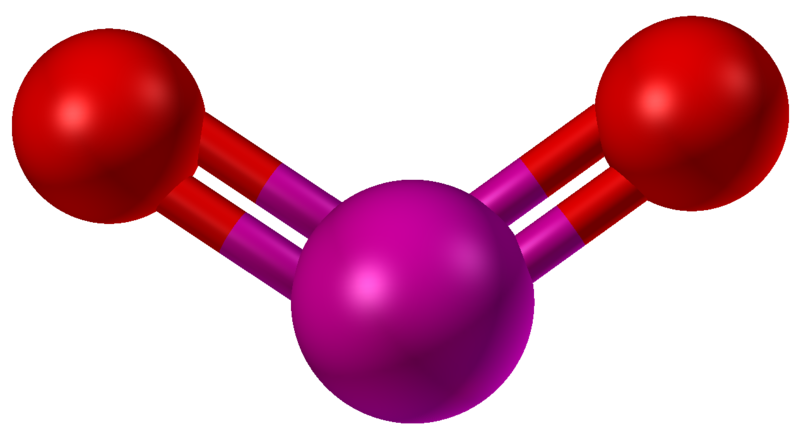
Chimia redox de bază a Mn este evaluată prin stabilitatea compușilor simpli cu oxigen și apă. Dioxidul de mangan, un compus de tip anorganic cu formula de oxigen și mangan MnO2, este adesea utilizat în metalurgie: Mn + O2 = MnO2. Este un solid de culoare închisă care este adesea utilizat pentru bateriile uscate, cum ar fi bateriile alcaline și bateriile carbon-zinc. În plus, merită menționat și oxidul de mangan (III), un compus anorganic care se prezintă sub formă de cristale negre-maronii care nu se dizolvă în apă. Reacția de oxidare este după cum urmează: MnO + O2 = Mn2O3. Oxidul de mangan are o gamă largă de aplicații în industria medicală, petrolieră, sticlei și chimică, metalurgia feroasă.
În ciuda tuturor compușilor posibili, Mn nu este deosebit de reactiv la aer, în ciuda faptului că este ușor mai electropozitiv decât vecinii săi din tabelul periodic. Suprafața aglomerărilor de mangan oxidează într-o măsură minoră. Manganul metalic fin arde în aer: 3Mn + 2O2 = Mn3O4; 3Mn + N2 = Mn3N2. Dioxidul de mangan nanostructurat și compozitele sale funcționează bine ca electrocatalizatori datorită morfologiei, structurii porilor și structurii cristalografice.
Reacția standard Mn + O2 = MnO2 are loc atunci când este încălzită la o temperatură care nu depășește 450°C. Cu toate acestea, peste 800°C, se formează oxid mixt de Mn (II, III). Este foarte important să se țină seama de acest lucru în producția la scară mare și mică.
Proprietățile oxidului de mangan

Proprietățile fizice ale Mn2O3 sunt următoarele
- aspect la lumină bună — cristale de culoare închisă;
- nu se dizolvă în lichide;
- se magnetizează într-un câmp magnetic extern.
Dintre principalele proprietăți chimice ale manganului plus oxigen se remarcă faptul că substanța se descompune la încălzirea cu temperaturi ridicate, când se aliază cu oxizi metalici, se obțin săruri de manganit, etc.
Oxizii au multe forme structurale cu o varietate de compoziții electrochimice. Ele și-au găsit o largă aplicare în diferite sfere de activitate datorită proprietăților lor chimice și fizice. Acest lucru explică popularitatea largă a elementelor. Dar atunci când se efectuează astfel de experimente, este necesar să se respecte regulile de siguranță, deoarece sunt adesea implicate temperaturi ridicate.