
Punctul de fierbere corespunde invers presiunii vaporilor substanțelor lichide și este legat pozitiv de presiunea atmosferei (aerului). În mod similar, punctul de topire depinde, de asemenea, de presiune. În majoritatea cazurilor, acești factori cresc. Explicația este destul de simplă: pentru ca orice substanță să se topească, aceasta trebuie să depășească sau să reducă forțele de influență care măresc particulele împreună în stare solidă. Pe măsură ce influența unei substanțe crește, particulele tind să rămână compacte, creșterea forței împiedică procesul de topire, făcând mai dificilă depășirea forței de atracție, ceea ce înseamnă că trebuie cheltuită mai multă energie termică.
Legile de dependență a temperaturii de topire de presiune
Întrebările cu privire la modul în care punctul de topire depinde de presiune au fost ridicate timp de mai multe secole. În urma experimentelor, mulți oameni de știință au demonstrat că, la presiune ridicată, o cantitate mare de energie termică de mișcare este utilizată pentru a rupe rețeaua cristalină în timpul topirii. Acest lucru poate fi urmărit prin construirea unei curbe. Dar datele sale vor diferi în funcție de starea substanței (lichid, solid).
Principalul model de dependență este că materialul este mai dens în stare solidă decât în stare lichidă, astfel încât gradul de topire va crește odată cu creșterea influenței. Acest lucru este explicat prin principiul lui Le Chatelier.
Există multe elemente diferite al căror volum nu scade la solidificare, ca în cazul multor substanțe, ci crește. Unul dintre cele mai bune exemple este gheața. Această substanță se dilată atunci când se topește, ceea ce înseamnă că, deși este solidă, este mai puțin densă decât un lichid.
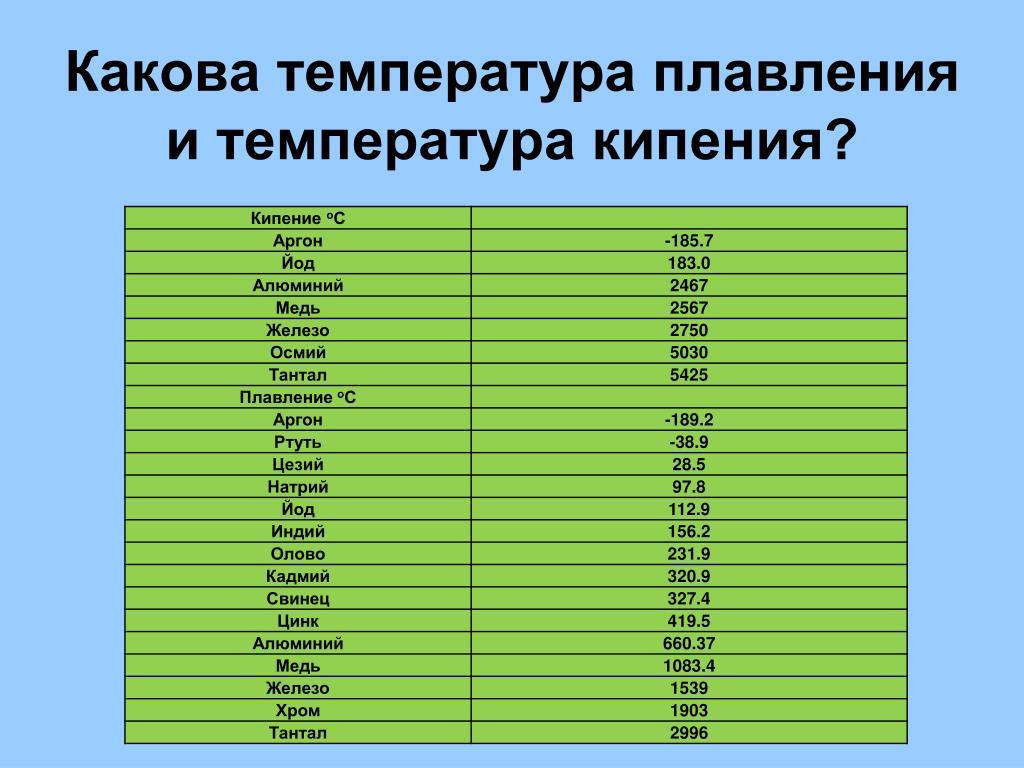
Alte substanțe cu caracteristici similare includ:
- germaniul;
- antimoniu;
- bismut, etc.
În orice caz, vor apărea modificări. Influența presiunii asupra punctului de topire este mult mai mică decât influența presiunii asupra punctului de fierbere. Deși principiul interacțiunii acestor factori este aproape identic.
Pentru metalele și aliajele aflate în stare de echilibru, volumul acestora crește, de asemenea, odată cu topirea. Aplicarea forței asupra acestor materiale suprimă expansiunea volumului și încetinește topirea. În consecință, indicele de topire crește atunci când se aplică o forță, deoarece va fi nevoie de mai multă energie pentru a face acest lucru, deoarece topirea crește suprafața și eliberează ioni și rețea. Acest concept este aplicabil majorității materialelor.
Ecuații de relație între mărimi
Pe internet pot fi găsite multe formule speciale pentru a ajuta la calcularea acestui factor. Una dintre cele mai cunoscute este considerată a fi ecuația lui Maxwell: dU=TdS-PdV. Ea ajută la înlocuirea cantităților nemăsurabile care apar în ecuațiile termodinamicii cu cantități măsurabile.
O altă ecuație este ecuația Clapeyron, derivată din cea precedentă, care poate fi utilizată cu ușurință pentru a calcula căldura de formare a vaporilor dacă modificarea presiunii în funcție de temperatură este deja cunoscută. Ecuația arată astfel: (dP/dT)=(dH/TdV).
Pentru a obține rezultate exacte, este important să se utilizeze mai multe formule. Procesarea datelor obținute va ajuta la determinarea cu exactitate a dependenței temperaturii de presiunea diferitelor elemente.







