Orice soluție este o substanță omogenă din punct de vedere chimic și fizic, cu proprietăți identice sau în continuă schimbare. Orice substanță conține impurități, adică este multicomponentă. În absența influenței impurităților asupra proprietăților studiate ale substanței, aceasta este considerată a fi monocomponentă, în caz contrar această substanță este considerată a fi o soluție. Să luăm în considerare dependența solubilității gazelor de temperatură și presiune în procesul de topire a metalului.
Conținut
Particularități ale soluțiilor
Compușii constau dintr-un solvent și o componentă dizolvată, pot dobândi orice stare de agregare — solidă, lichidă, precum și gazoasă. De regulă, rolul de solvent este atribuit componentei predominante în amestec sau substanței care cristalizează prima în timpul procesului de răcire a soluției. Atunci când componentele lichide sunt amestecate cu gaze, solventul este considerat a fi lichidul. Din punct de vedere termodinamic, această împărțire a componentelor soluției este condiționată. Determinarea concentrației se realizează prin următorii indicatori:
- molar;
- normal;
- molar;
- procentual;
Un alt mod de determinare a concentrației este raportul dintre numărul de moli ai unui component și numărul total de moli ai tuturor componentelor sistemului.
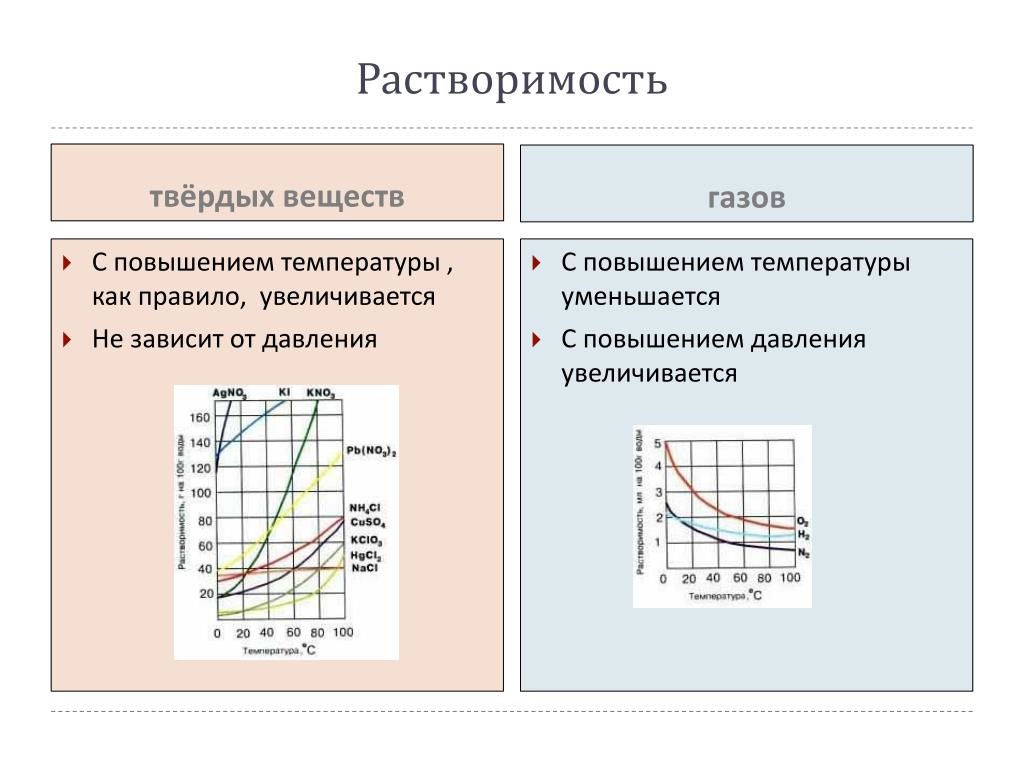
Solubilitatea gazelor în metale
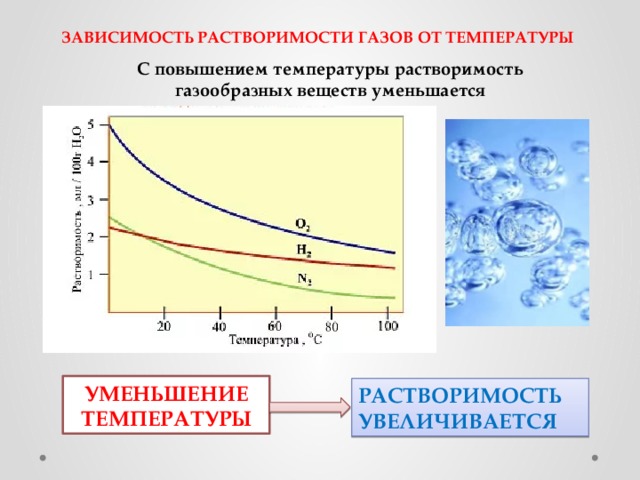
Conform cursului cercetărilor, solubilitatea gazelor în metale în timpul topirii diferă de procesele similare de formare a soluțiilor gazoase în alte substanțe lichide. Principalul argument este regimul de temperatură al reacției: odată cu creșterea acestui indicator, concentrația de gaze în majoritatea metalelor crește, în timp ce în soluțiile apoase este eliberată și, în consecință, cantitatea sa în apă scade. Această discrepanță este nivelată atunci când se ia în considerare întregul proces în dinamică — de la starea solidă a metalului până la fierberea acestuia.
În starea solidă a metalului, indicele este scăzut, dar solubilitatea gazelor la o creștere bruscă a temperaturii crește și atinge un maxim la punctul de topire. De fapt, în stare lichidă, metalul este capabil să dizolve volume mult mai mari de gaze decât substanța este solidă, iar acest indicator crește odată cu creșterea temperaturii aliajului preparat. Cu toate acestea, după ce a atins maximul, solubilitatea scade, iar la punctul de fierbere este stabilită mai aproape de zero. Dacă comparăm graficele solubilității gazelor în apă și în aliaje, devine clar că în ambele cazuri sunt luați aceiași indici.
Presiunea și indicii de solubilitate a gazelor
S-a demonstrat prin același experiment că solubilitatea gazelor crește considerabil odată cu creșterea presiunii. Indicele este influențat în mare măsură de factorul de elasticitate la vapori al metalului. De exemplu, zincul are o valoare ridicată a elasticității vaporilor. Având un anumit grad de dezintegrare în atomi, moleculele în procesul de selecție sunt înlocuite cu altele noi, menținând un anumit nivel de concentrație în substanță. Iar procesul este influențat atât de anumite temperaturi, cât și de presiune.
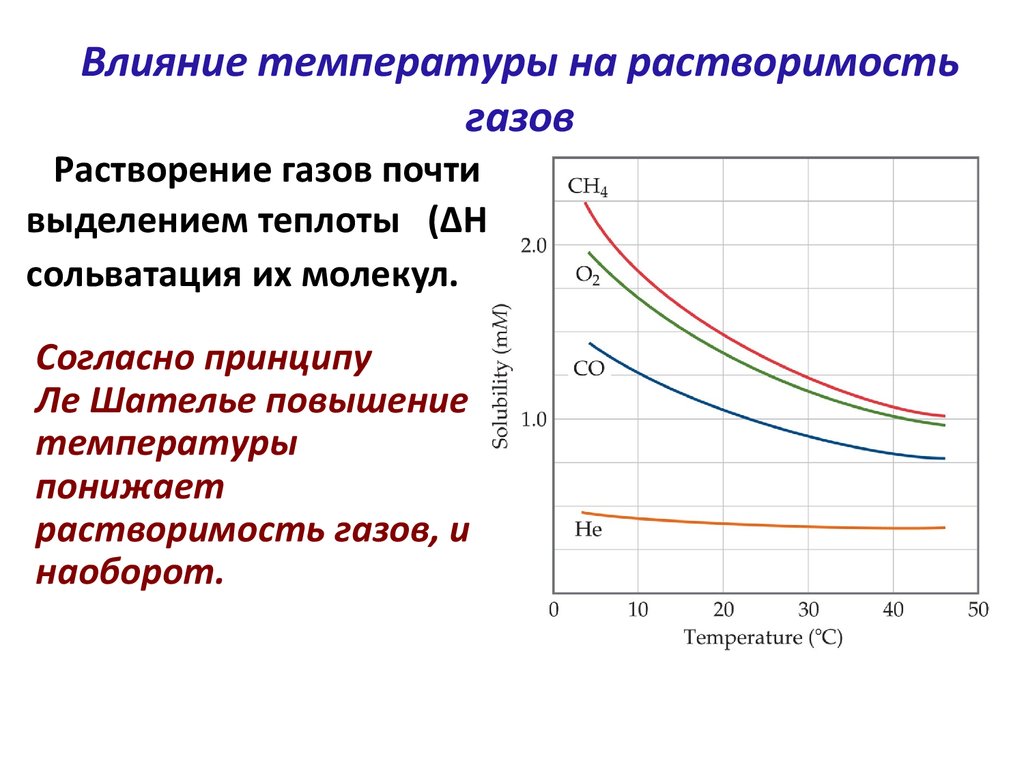
Conform experimentelor efectuate cu privire la gradul de influență a presiunii asupra indicelui de solubilitate a gazelor, în stare atomică hidrogenul părea să pătrundă cel mai ușor în metalul lichid. Inițial, introducerea are loc în straturile de la suprafață, apoi difuzia se adâncește, iar noi atomi de gaz sunt introduși din aer. Odată cu expunerea prelungită la gaz, pe măsură ce metalul se saturează, curba de dizolvare atinge o anumită limită. Valorile temperaturii, presiunii și conținutului de gaz înregistrate în acest moment determină în continuare indicele de solubilitate în gaz.