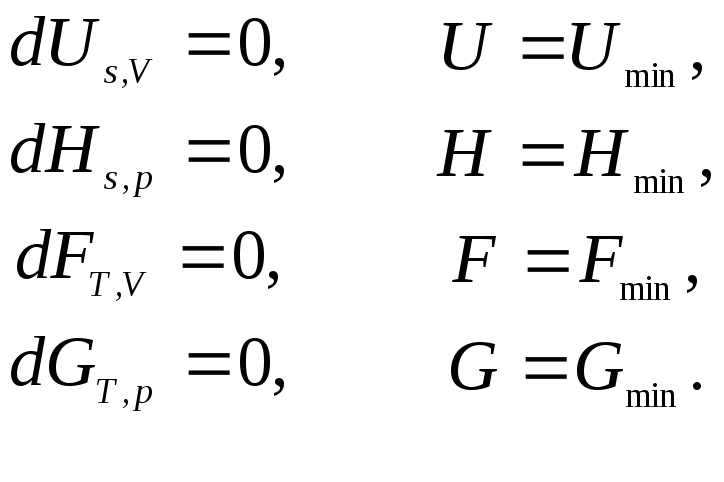În jurul nostru există procese chimice unice și surprinzătoare despre care merită să vorbim. Unul dintre acestea este echilibrul termodinamic. Acesta este un proces în care starea unui sistem nu tinde să se schimbe spontan. Acest lucru se poate realiza numai prin modificarea externă a uneia dintre funcțiile de stare. Pentru un sistem în echilibru termodinamic cu o energie dată, entropia, adică măsura haosului, este mai mare decât cea a oricărei alte stări cu energie identică.
Oamenii de știință au observat că unele proprietăți ale unui obiect, cum ar fi presiunea într-un volum de gaz, lungimea unei tije metalice sau conductivitatea electrică a unui metal, se pot modifica odată cu creșterea sau scăderea temperaturii. Atunci când schimbarea acestor proprietăți încetează, se spune că starea obiectelor este de echilibru termodinamic sau termic.
Conținut
Cerințe pentru echilibrul termodinamic

De fapt, echilibrul descrie o stare de dispariție a forțelor motrice sau a gradienților, în timp ce lucrurile rămân așa cum sunt. Pentru a atinge echilibrul termodinamic, există anumite condiții: toți parametrii intensivi (temperatură, presiune) și extensivi trebuie să fie stabili (constanți). În consecință, oricare dintre aceste proprietăți trebuie să fie zero.
Iată care sunt cerințele de bază:
- temperatura tuturor părților sistemului trebuie să fie aceeași;
- nu trebuie să existe forțe totale dezechilibrate într-o parte sau în întregul sistem;
- nu trebuie să existe nicio modificare în reacția chimică.
Pentru ca un sistem să fie în echilibru, stările mecanică, termică și chimică trebuie să fie stabile. În cazul în care oricare dintre condițiile de mai sus nu sunt îndeplinite, se spune că sistemul se află într-o stare de neechilibru.
Cum se desfășoară reacțiile având în vedere echilibrul termodinamic?

După ce ați învățat despre condițiile termodinamice ale echilibrului chimic, echilibrului mecanic și echilibrului termic, este ușor să puneți cunoștințele în practică. Pentru mulți profesioniști, condiția de stabilitate este importantă pentru experimente, deoarece permite ca două elemente diferite să interacționeze, schimbându-și proprietățile.
Un exemplu este reacția hidratului de sare de masă pentru aplicații termice. Aceasta ia în considerare parametri precum eficiența teoretică, densitatea de stocare și temperatura de stabilitate. Reacția de hidratare, în care toți precursorii și produsele rămân solizi, poate fi tratată similar sistemelor de adsorbție.
Având în vedere condițiile termodinamice ale echilibrului în termodinamică, se poate asigura o entalpie ridicată a reacției. În acest scop, este important să se utilizeze ecuația Clapeyron. Aceasta poate fi utilizată pentru a calcula presiunea de vapori de echilibru a fiecărei reacții de hidratare în funcție de temperatură, utilizând entalpia reacției și energia liberă Gibbs. În acest fel, se poate obține echilibrul termic al vaporizării sau condensării.
Criterii pentru modificarea echilibrului termodinamic
Starea de stabilitate este conservarea stării actuale. Aceasta poate fi modificată numai dacă sunt afectate alte sisteme. Dacă două sisteme diferite intră în contact fizic, proprietățile lor se schimbă. Același lucru se întâmplă dacă temperatura este crescută. În unele cazuri, pot apărea schimbări în fazele însele.

După cum am realizat deja, echilibrul termic al unui sistem poate fi ușor schimbat. Dar poate fi schimbată starea obiectului în sine? Da. Pentru un metal, acest proces se numește recristalizare. Acesta implică nu numai formarea, ci și creșterea granulelor cristaline ale unui policristal în detrimentul altor granule.
Acum ați învățat despre acest proces și despre condițiile care trebuie îndeplinite pentru realizarea lui.