Durrer R. și G. Volkert observă că producția industrială mondială de mangan este organizată pe baza electrolizei unei soluții de sulfat de mangan divalent, al cărei potențial electronegativ este egal cu — 1,05 V. Care sunt condițiile obligatorii care trebuie respectate în timpul electrolizei pentru a asigura producerea economică a manganului? Sub acest aspect economic este necesar, în primul rând, să se utilizeze minereuri bogate de pirolusit (concentrate) cu un conținut cât mai scăzut posibil de fier și metale neferoase, iar prăjirea prin reducere a acestora în scopul reducerii Mn 4+ → Mn 2+ trebuie efectuată în conformitate cu regimul care asigură o extracție ridicată a manganului în soluție, păstrând fierul în reziduul solid. În etapa de purificare a soluției este necesară purificarea acesteia cât mai complet posibil de metale neferoase, așa-numitele otrăvuri electrolitice. Cerințele extrem de stricte privind puritatea electrolitului în ceea ce privește conținutul de diverse elemente (Co, Ni, Cu, As, Sb, Ag, Zn etc.) se datorează faptului că și microcantitățile acestora provoacă dizolvarea manganului eliberat, ceea ce este însoțit, potrivit lui A. Sally, de pierderea a până la 30-40% din energia electrică utilizată în electroliza manganului, iar randamentul curentului este de 60-70%. Electrolitul este un acid diluat H2SO4 cu sulfat de mangan dizolvat MnSO4; Manganul poate fi separat la catod la pH ≥ 7 prin electroliză, astfel încât este necesar ca spațiile catodic și anodic să fie izolate unul de celălalt în electroliză. Spre deosebire de spațiul catodic, unde pH ≥ 7, spațiul anodic trebuie să aibă un mediu acid. Din acest motiv, diafragmele sunt obligatorii în electrolizoarele pentru extracția manganului din soluția MnSO.4 În cazul unei soluții de MSO, se utilizează în mod obligatoriu diafragme. Valoarea pH-ului electrolitului în partea catodică a electrolizorului este ușor modificată prin evoluția hidrogenului, iar în spațiul anodic manganul poate fi oxidat la MnO2. În acest sens, capacitatea maximă de curent ridicat este, de asemenea, limitată, deoarece difuzia liberă a anoliticului către catod reduce pH-ul catolitului.
Cele mai importante condiții ale parametrilor de extracție electrolitică a manganului includ: compoziția și temperatura electrolitului, densitatea curentului, tipul de diafragme, agitarea soluției, materialul anodului și catodului. De mare importanță pentru compoziția electrolitului este sulfatul de amoniu (NH4)2SO4care crește conductivitatea electrică a electrolitului și reglează pH-ul. O proprietate importantă a sulfatului de amoniu este și aceea că, la valoarea optimă a pH-ului electrolitului, acesta împiedică precipitarea hidroxidului de mangan datorită formării de săruri complexe cu ionii de mangan. Prezența (NH4)2SO4 în electrolit se explică și prin împiedicarea transferului de oxid la mangan în timpul eliberării acestuia în procesul de electroliză. Importanța menținerii stricte a temperaturii într-un interval dat este redusă la faptul că, chiar și cu abateri mici ale acesteia, este posibilă precipitarea cristalelor, deoarece electrolitul este, în general, o soluție apropiată de starea saturată a sărurilor.
Conținut
Tehnologia manganului electrolitic în condițiile ZFZF
Calitatea manganului electrolitic produs la moară este reglementată de GOST 6008-82 (clasa Мр00, Мр0). Pot fi utilizate ca materii prime minereurile și concentratele de oxid de chiatură (versiunea peroxid a tehnologiei) sau minereurile și concentratele de carbonat (versiunea carbonat).
Tehnologia include următoarele etape principale:
- prăjirea prin reducere a concentratelor de oxizi și a minereurilor la 700 °C; A. Sully observă că, dacă concentratul de minereu are un conținut mai scăzut de oxid de fier, temperatura de prăjire poate fi mărită;
- levigare;
- purificarea soluțiilor de impurități;
- electroliza.
La uzină a fost construit un cuptor turbionar cu două trepte (fig. 15.2) pentru prăjirea reductivă a concentratelor de mangan, cu o capacitate de 70/zi.
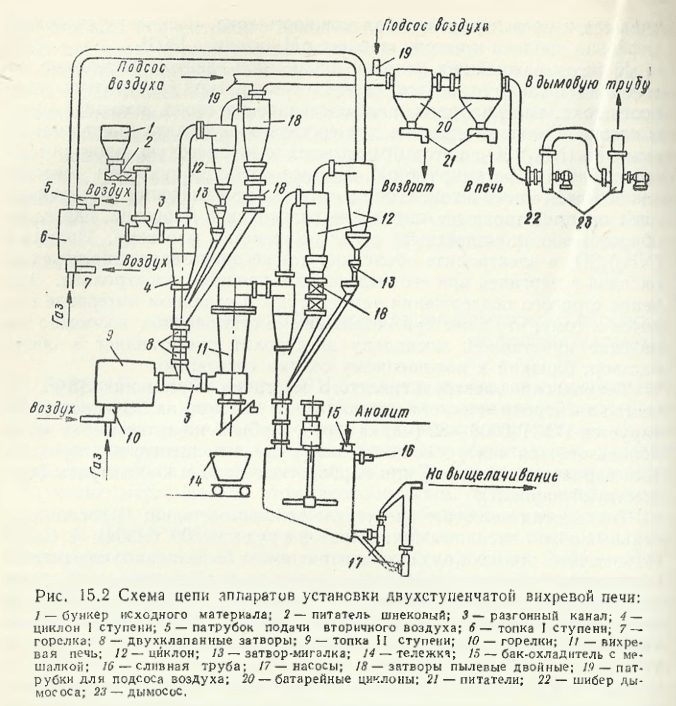
În prima etapă, concentratul de mangan preuscat și mărunțit cu grosimea de 1-0 mm este supus încălzirii până la 400 °C în ciclonul primei etape. În același ciclon se captează până la 70 % din concentratul tratat, iar cantitatea rămasă — în ciclonii de grup 12 (a se vedea fig. 15.2) și prin porțile de blinker 13 și porțile de câmp dublu 18 este conectată la masa principală de concentrat. Concentratul încălzit intră apoi în canalul de dispersie al etapei a doua de tratare a concentratului, în care sunt introduse produse ale arderii incomplete a gazelor naturale la 1100-1200 °C din cuptorul etapei a doua. Suspensia de gaz cu o viteză de 40 m/s intră în continuare în partea inferioară — voluta cuptorului vortex 11, în care capătă mișcare de rotație, iar de acolo — în zona de lucru a cuptorului vortex. Faza gazoasă din cuptor are compoziția, % (vol.): CO 91; C2H6 1,3; C3H8 1,0; C4O10 0,3; CO2 0,1 și N26,8. În aceste condiții (compoziția fazei gazoase și temperatura) are loc reducerea oxizilor de mangan superiori conținuți în minereurile minerale la Mn 2+ O inferior. În plus, gradul de reducere a manganului (adică raportul dintre fracția masică de mangan divalent și conținutul total de mangan din concentratul inițial) este de 70-80 %, ceea ce este mai mare decât acest indicator în cazul prăjirii concentratului într-un cuptor cu tambur care utilizează păcură. Concentratul gravitațional Chiatura de primă calitate prelucrat în cuptorul cu vârtej are compoziția, %: Mn 53,7; MnO 54,3; Fe2O3 1,7; SiO2 12,4; CaO 4,42; P2O5 0,46; S 0,30; p. p. p. 3,6.
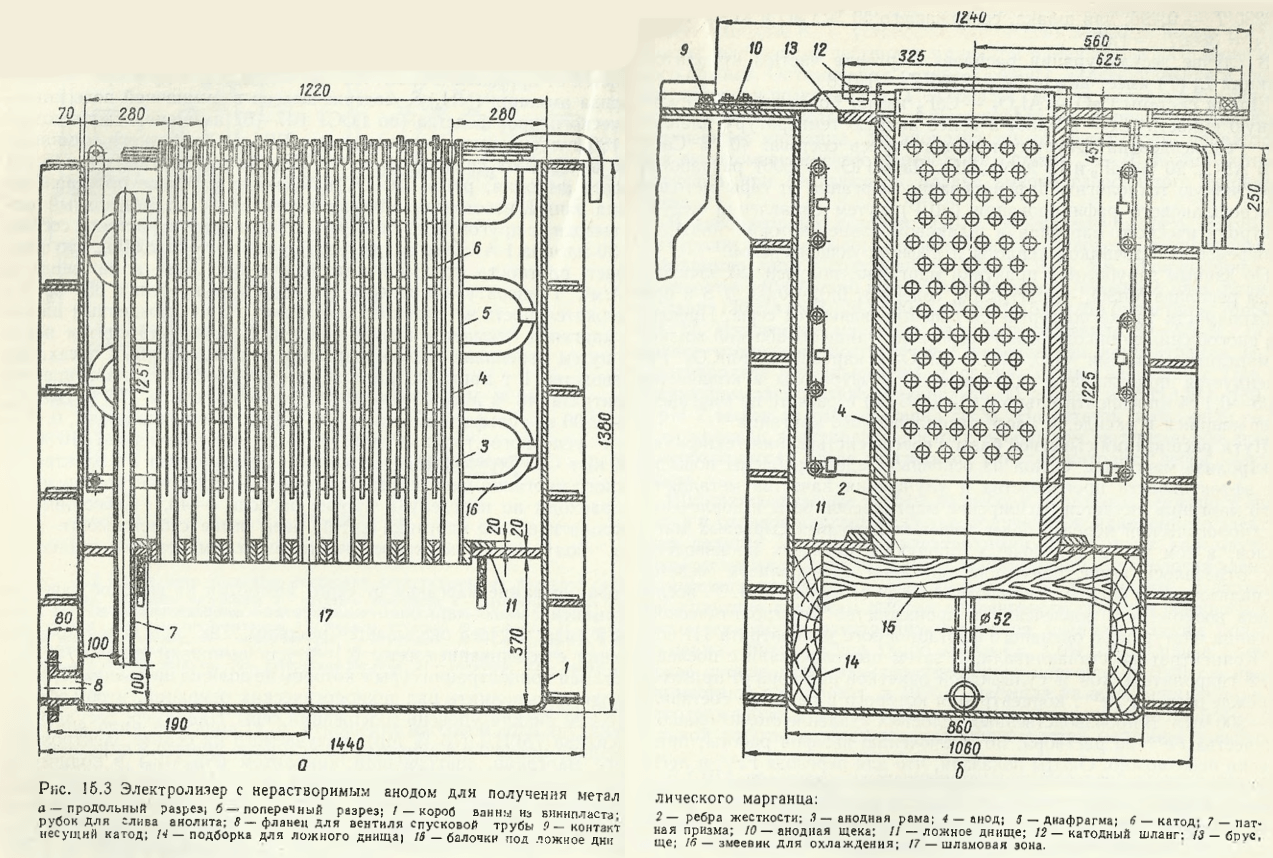
Minereul recopt este levigat cu anolit reciclat (15-17 Mn g/l) sub formă de sulfat (MnSO4); 135-145 g/l (NH4)2SO4 și 20-25 g/l H2SO4. În soluția de levigare se adaugă acid sulfuric (GOST 2184-67) și sulfat de amoniu (GOST 9097-65), în urma cărora concentrația de H2SO4 este crescută până la 45-50 g/l și (NH4)2SO4 — la 150-165 g/l. Procesul de levigare se desfășoară până la neutralizarea completă a anolitului (pH = 3,5…4,5), la care concentrația de mangan în soluție crește până la 40 g/l, iar (NH4)2SO4 — până la 180 g/l. Soluția este purificată de impurități (Fe, Ni, Al, Co, Mg, Cu, P etc.) cu ajutorul sulfurii de amoniu (NH4)2S conținut în apa amoniacală din producția de cocschimie (conform GOST 647-67, apa amoniacală conține 180 g/l de sulfură de amoniu și până la 210 g/l de amoniac liber). După purificarea de impurități, soluția (33-35 g/l de mangan și 145 g/l de sulfat de amoniu, pH = 7,0…7,5) este introdusă în spațiul catodic de la capătul băii din plastic vinilic (fig. 15.3). Soluția anodică este evacuată din celălalt capăt al băii. Rata de schimb a soluției este de 30 ml/h pe 1 A. Electroliza se realizează la o intensitate a curentului de 2000 A, care asigură un curent dens la catod de 300-350 A/m 2 , iar la ano d-700 A/m 2 . Temperatura procesului este cuprinsă între 35-38 ° C; durata electrolizei este de 24 de ore. Manganul depus pe catod este îndepărtat sub formă de fulgi. Lingoul compact se obține prin retopirea fulgilor de mangan în cuptoare cu inducție. Pentru a produce 1 tonă de mangan, sunt necesare 4000-4200 kg de concentrat de mangan (48 % Mn), 1300-1500 kg de acid sulfuric (75 % H2SO4), 1600-1900 kg de sulfat de amoniu, 500-550 kg de apă amoniacală, 0,45-0,50 tone de echivalent combustibil cu un consum de energie electrică de 10.500-12.000 kWh. Structura costului de producție a 1 tonă de mangan electrolitic este următoarea, %: materii prime — 29,6, energie electrică — 22,3; conversie și alte cheltuieli — 48,1. Costul manganului electrolitic este de trei ori mai mare decât costul manganului produs prin metoda de producție electrosilicotermică.
Rafinarea manganului din sulf
În ciuda calității ridicate a manganului electrolitic, cantitatea de impurități conținută în acesta este ridicată în unele cazuri. De exemplu, atunci când se utilizează mangan cu un conținut de sulf de 0,1 % pentru topirea aliajului 75GND, a cărui concentrație admisă de sulf nu trebuie să depășească 0,02 %, este necesar să se efectueze o serie de operațiuni tehnologice pentru a asigura un nivel mai scăzut al conținutului de sulf. De exemplu, desulfurarea aliajului 75GND (75 % Mn), produs pe bază de mangan electrolitic, a fost efectuată cu criolit (Na3AlF6) în cantitate de 1,54 % din masa încărcăturii. Aliajul tratat conținea mai puține impurități nocive: sulf, oxigen, azot, iar monoxidul de carbon al manganului a fost redus la jumătate. Cu toate acestea, metoda de desulfurare a manganului metalic inițial ar trebui să fie recunoscută ca fiind mai promițătoare. Tsikaridze N. N. a studiat desulfurarea manganului electrolitic într-un cuptor cu inducție cu zgură din sistemele MnO — SiO2 și CaO — Al2O3. S-a stabilit că zgurii acide cu conținut ridicat de mangan pe bază de Mno — SiO2 65-66 % MnO; 32-33 % SiO2au o capacitate ridicată de desulfurare. Dependența logaritmului coeficientului de distribuție a sulfului între zgura cu compoziția de mai sus și mangan de temperatură este următoarea
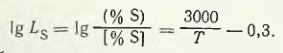
Deoarece tratarea manganului electrolitic cu zgură acidă duce la o creștere bruscă a conținutului de siliciu din metal, se recomandă zgura bazată pe sistemul CaO — Al.2O3 cu adaos de fluorină și criolit. Investigațiile privind influența compoziției zgurii și a temperaturii (1754-1934 K) asupra coeficientului de distribuție a sulfului au permis obținerea următoarelor dependențe Ls (Т). Pentru zgura care conține 35 % CaO și 62 % Al2O3, această relație are forma lg Ls = 2250/T — 0,495; pentru zgura care conține 50 % CaO și 47 % Al2O3, lg Ls = 3800T — 1,03.
În cazul desulfurării topiturii de mangan cu criolit pur, funcția Ls (T) are forma lg Ls = 3500/T — 1,028.
Zgură de CaO — Al2O3 — CaF2 au o capacitate de sulfurare mai mare (Ls = 20…30) și un punct de topire mai scăzut. Compoziția recomandată a amestecului desulfurator este 40 % CaO; 20 % Al2O3; 20 % CaF2 și 12 % Na3AlF6. Latash Yu. V. a dezvoltat o tehnologie eficientă de rafinare a manganului din sulf prin rafinare electrolitică (ESR) prin fuziunea fulgilor de mangan electrolitic într-o baie de zgură, care este atât o sursă de căldură, cât și un mediu de rafinare.
Conform datelor din practica străină, manganul obținut prin electroliza de MnSO melt4 — (NH4)2SO4conține 0,02-0,03 % S și, dacă este necesar, este supus, de asemenea, rafinării de sulf. O metodă de reducere a conținutului de sulf din mangan prin tratarea manganului lichid cu oxizi MnO, MnO2Mn2O3 și carbonat MnCO3. Se recomandă adăugarea acestor agenți de desulfurare în cantitate de 0,005-0,1 % (de preferință 0,01-0,05 %) per mangan conținut în oxid la masa de mangan topit.
Modalități de extindere a bazei de materii prime și de îmbunătățire a tehnologiei de electroliză a manganului
Unul dintre obiectivele principale ale problemei creșterii eficienței producției și a îmbunătățirii calității manganului metalic este extinderea bazei de mangan și implicarea materiilor prime mai ieftine, inclusiv a subproduselor din industriile conexe, în prelucrarea tehnologică. După cum s-a menționat mai sus, producerea manganului prin electroliză se realizează folosind minereuri bogate de pirolusit. V.T. Akhobadze a studiat posibilitatea implicării concentratului de flotare a oxidului Chiatura de gradul III în producția de mangan electrolitic. Concentratul a fost recuperat și apoi levigat cu purificarea hidrolitică și sulfuroasă ulterioară a soluției de impurități și, în primul rând, de Fe 2+ , a cărui concentrație în soluție era de 250-300 mg/litru. În condiții industriale, eliminarea unei cantități atât de mari de Fe 2+ din soluție, conform concluziei autorilor lucrării, este practic imposibilă. Experimentele au arătat că, pentru transformarea Fe 2+ în Fe 3+ sub formă ușor hidratată, este necesar să se introducă 2-4 kg/m 3 de concentrat de peroxid măcinat de gradul III în soluție în etapa de levigare și să se aducă pH-ul la 5,0-6,0. O altă sarcină dificilă a fost stabilirea parametrilor de levigare care ar exclude sau ar reduce levigarea compușilor silicatului din concentratul de flotație. După cum se știe, silicații (inclusiv SiO2) în timpul levigării concentratelor cu medii acide formează acid silicic, care, atunci când este neutralizat, se transformă în silicagel. Pulpele (soluțiile) care conțin silicagel sunt foarte slab filtrate. Specialiștii s-au confruntat cu această problemă atunci când au stăpânit procesul de ditionat de îmbogățire a nămolului de mangan la Uzina de extracție și prelucrare a manganului. V.T. Akhobadze a stabilit că gradul de SiO2 în soluție în timpul levigării crește odată cu creșterea temperaturii de prăjire reducătoare. Optimizarea regimurilor de prăjire, levigare și purificare a soluției i-a permis lui V.T. Akhobadze să concluzioneze că este posibilă utilizarea concentratului de flotație pentru producerea manganului electrolitic. De asemenea, a fost stabilită posibilitatea utilizării zgurii de conversie cu conținut ridicat de mangan, cu 35-40 % Mn, care se obține prin topirea fără flux a ferromanganului cu conținut ridicat de carbon.
În condiții de laborator, a fost studiată posibilitatea obținerii manganului electrolitic din zgură de producție de silicomangan și ferromangan care conține 9,5-37,2 % Mn. Măcinate la grosime < 0,074 мм шлаки обрабатывали анодным электролитом состава: 130 г/л (NH4)2SO4; 30 g/l H2SO4; 15 g/l Mn (în soluție de MnSO4); pH 12. Recuperarea manganului din zgură a fost de 80-95 %. Se obține o extracție mai completă cu creșterea concentrației de H2SO4 în electrolit și scăderea raportului zgură : electrolit. La electroliza ulterioară a electrolitului de 30 g Mn/l și (NH4)2SO4 130 g/l și pH 7, randamentul curentului a fost de 60 %. Dezavantajul acestui tip de materie primă și de tehnologie de electroliză este fluxul mare de material și necesitatea unei purificări mai aprofundate a catolitului înainte de electroliză.
Institutul de Electrochimie al Academiei de Științe din Georgia, sub îndrumarea științifică a fondatorului teoriei și tehnologiei de producere electrolitică a manganului, Acad. R. I. Agladze. În practica străină se acordă, de asemenea, o atenție deosebită problemelor legate de selectarea materiei prime de mangan și de îmbunătățirea tehnologiei electrolizei manganului. Firma „Chuo Denld kogvo Co. Ltd”, care a început producția comercială de mangan electrolitic în 1940 și a utilizat rodocrositul local, a trecut în 1976 la minereul recopt conținând pirolusit, care oferă posibilitatea unei funcționări mai stabile în toate etapele producției de mangan prin electroliză.
În SUA este propusă o metodă îmbunătățită de electroliză a manganului, care constă în următoarele. Soluția care conține mangan intră în receptor, unde este amestecată cu o soluție apoasă care conține polimeri solubili în apă pe bază de poliacrilamidă
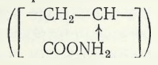
și galactomanină naturală 0,1-10 mg/litru. De la receptor, soluția este trimisă la un electrolizor pentru depunerea manganului pe catod. O parte din electrolitul uzat îmbogățit în H2SO4este returnată în receptor, iar 10 % (vol.) din aceasta este scoasă din proces și utilizată, de exemplu, la levigat. Electrolitul lipsă este completat cu o nouă porție de soluție conținând mangan. Electroliza se efectuează în conformitate cu tehnologia obișnuită. Adăugarea componentei organice la electrolit a permis obținerea unei suprafețe mai netede a manganului catodic.
Gotsiridze Sh. P. și E. A. Kochiashvili pentru a reduce concentrația de nichel și cobalt în electrolit au utilizat rășină schimbătoare de ioni (amfitolit de calitate ANKB-2). La un raport rășină : electrolit = 1:100, distribuția de echilibru a nichelului și cobaltului între rășină și soluție este atinsă după cinci ore de înmuiere. Gradul de sorbție a nichelului și cobaltului a fost de 99,15 %.
În etapa de desorbție, manganul sorbit de rășină împreună cu nichelul și cobaltul trec în eluent, ceea ce complică prelucrarea hidrometalurgică ulterioară a acestuia. Pentru a extrage manganul și a-l separa de nichel și cobalt, Sh. P. Gotsiridze, E. A. Kochiashvili au propus tratarea eluentului în două etape. Eluția manganului cu H2SO4 în prima etapă, în conformitate cu următorul regim: concentrația de H2SO4 40 g/l, durata 1,5 h, raportul ionit : eluent 1 : 1 — a asigurat separarea manganului. În a doua etapă — eluția nichelului și cobaltului cu soluție H2SO4 (150-200 g H2SO4/L, durata 1,5 h, raportul ionit : eluent = 1:2), extracția nichelului și cobaltului a atins 100 %. Eliuatul obținut de NiSO4 12,2 g/l, CoSO4 1,2 g/l este adecvată pentru prelucrarea hidrometalurgică în vederea extragerii nichelului și cobaltului.
Gvalya I.G. și R.I. Agladze au studiat influența acidului oxalic asupra formării nămolului în procesul de producție electrolitică a manganului. Rezultatele măsurătorilor de polarizare au arătat că H2C2O4 acționează în principal în procesul de formare a peliculei pasive. Anionul SO 2- 4 este înlocuit cu C2O4 2- , iar PbC2O4 împreună cu PbSO4 este implicat în construcția filmului anodic. Astfel, prezența H2C2O4 contribuie la formarea de PbC greu solubil și slab permeabil pe anodul de plumb2O4ceea ce duce la o scădere a centrelor active ale electrodului și împiedică pătrunderea ionilor de plumb divalenți prin pelicula de sare. Potrivit lui I.G. Gvalya și R.I. Agladze, scăderea centrelor active ale electrodului este motivul pentru creșterea densității de curent anodic adevărat care duce la formarea β-PbO2iar împiedicarea pătrunderii ionilor de Pb 2+ este motivul scăderii cantității de PbO format pe electrod.2. Astfel, conform concluziei acestor cercetători, scăderea cantității de PbO2 și formarea de MnO mai dens pe electrod2 în prezența H2C2O4 este o consecință a scăderii vitezei de reacție de oxidare a ionilor divalenți de mangan.
Cele de mai sus nu se limitează la utilizarea electrozilor care conțin mangan. Utilizarea MnSO4 în compoziția electrolitului care conține și ZnSO4 și Na3C6H5O7pentru aplicarea de acoperiri de protecție pe caroserii din oțel. Acoperirea conține 30-50 % Mn și are o rezistență ridicată la coroziune atât pe suprafața vopsită, cât și pe cea nevopsită, o bună sudabilitate și alte proprietăți pozitive.
Tehnologia de producție a manganului electrolitic de înaltă puritate
Diferența esențială a tehnologiei de producere a manganului metalic de înaltă puritate de calitate МрОО (GOST 6008-85), stăpânită în electrolizoarele industriale de la ZZPF, constă în purificarea profundă a electrolitului de metale grele, folosind rășina schimbătoare de ioni ANKB-2 în locul purificării tradiționale a sulfurilor.
Lucrarea prezintă rezultatele tehnologiei testate pentru obținerea manganului de calitate MnOO ≥ 99,85 % Mn, ≤0,10 % C, ≤0,01 % P, ≤0,10 % S, care se caracterizează prin următoarele dispoziții principale. Lixivierea concentratului de mangan Chiatura de primă calitate, redus în prealabil, se efectuează cu electrolit uzat, a cărui compoziție este corectată înainte de levigare cu H2SO4 și (NH4)2SO4. Astfel, levigarea se realizează cu următoarea soluție: mangan 12-16 g/l, acid sulfuric 40-50 g/l și sulfat de amoniac 150-160 g/l. Procesul de levigare a manganului este descris de reacția
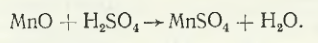
Procesul de levigare se desfășoară până când se obține o soluție de 35 g Mn/l și 150-160 g (NH4)2SO4/л. Soluția după levigare este păstrată în bazine de decantare, iar apoi cantitatea principală de impurități de metale grele este eliminată prin tratare cu sulfuri. În scopul unei purificări mai profunde de nichel și cobalt, o parte din soluția inițială este purificată cu ajutorul rășinii schimbătoare de ioni ANKB-2 (ionite). Aceasta din urmă este un sorbent selectiv granular de culoare galben deschis (densitate aparentă 0,6 kg/l, volum specific 2, 5-3,2 ml/g, dimensiunea granulelor 0,1-0,4 mm).
Durata sorbției nichelului, cobaltului și a altor metale grele din soluție de către ionit (la raportul sorbent : soluție = 1 : 50) este de 3-4 ore. Valoarea pH-ului soluției purificate este crescută de la 4 la 7 prin adăugarea de amoniac apos. Această soluție este introdusă în rezervoare speciale, iar de acolo ajunge în rezervorul de presiune pentru a alimenta electrolizoarele. Na2SO4 (la o rată de 0,2 g SO2/L) pentru a asigura desfășurarea normală a electrolizei. Aplicarea tehnologiei descrise cu utilizarea ionitei ANKB-2 permite obținerea manganului de o puritate mai mare în ceea ce privește conținutul de impurități în comparație cu purificarea soluției sulfurate, ceea ce rezultă din datele de mai jos, %:
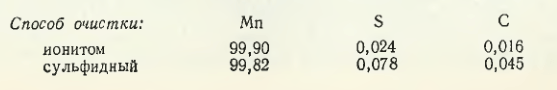
În perioada experimentală, concentratul de mangan recopt a fost utilizat pentru levigare în conformitate cu tehnologia existentă și experimentală, %: Mn 55,72; SiO2 10,36; Al2O3 4,17; Fe2O32,58; CaO 3,60; MgO 0,80. Precipitantul metalelor neferoase la purificarea sulfurilor în conformitate cu tehnologia actuală conținea 80 g H2S/l, sulf polisulfurat 4,5 %, apă amoniacală 1,8 % NH3.

Nămolul după levigare conținea, %: Mn 40,62; SiO2 12,31; CaO 3,4; Al2O3 4,9; Fe2O33,6; MgO 0,85. După purificarea sulfurilor din soluția de sulfat de mangan se formează suspensia, %: Mn 31,72; SiO2 12,65; CaO 3,2; Al2O3 3,2; Fe2O3 1,35; MgO 0,80.
Bilanțul material al manganului în ciclul tehnologic în cadrul schemei de operare a arătat că 40,0 Mn a fost transferat în metal, 5,08 a rămas în anolit, iar la utilizarea sorbentului — 40,8 și, respectiv, 8,6 %. Cu nămolul de levigat în ambele scheme tehnologice pierderile de mangan fac 49,0. În cazul purificării cu soluție schimbătoare de ioni nu se pierde mangan, iar în cazul purificării cu sulfură 4,6 % se transferă în zgură. Pierderile de mangan neînregistrate în bilanțul materialelor au fost egale cu 1,6 % în cazul tratării cu sorbenți și cu 1,4 % în cazul tratării cu sulfuri. În general, recuperarea manganului în tehnologia pilot a atins 49,5 %, iar în tehnologia operațională 45,0 %. În cazul aplicării rășinii schimbătoare de ioni pentru purificarea soluției de sulfat de mangan de metale grele, indicatorii tehnici și economici ai producției de mangan s-au îmbunătățit, de asemenea (tabelul 15.2).
După cum reiese din datele din tabelul 15.2, consumul specific de acid sulfuric crește cu 300 kg (pentru 1 tonă de mangan metalic) în conformitate cu noua tehnologie stăpânită, care este legată de regenerarea sorbentului. În prima etapă, regenerarea sorbentului se realizează în electrolit uzat (anolit) care conține 50 g/l H2SO4timp de 0,5 h. Apoi sorbentul este tratat cu o soluție apoasă de acid sulfuric cu o concentrație de 250-300 g/H2SO4 la un raport ionit : eluent = 1 : 1 (în volum). Procesul de regenerare continuă timp de 3 h. Concentrația de nichel și cobalt în eluent după regenerare este de 4,0 g Ni/L și 0,35 — 0,4 g Co/L. Autorii notează că eluentul poate fi utilizat în mod repetat, iar ionita reface aproape complet capacitatea de sorbție.
Cercetările științifice pentru o metodă de obținere a manganului electrolitic, pur în sulf și alte impurități, continuă și acest lucru se datorează faptului că, după cum au confirmat M. P. Ravdel, T. S. Rodina, proprietățile semnificative și deformabilitatea aliajului 71GYu sunt determinate în mare măsură de puritatea manganului și că clasa de mangan Mr1 (producție electrosilicotermică) nu este potrivită pentru producerea acestui aliaj.
Procesul de desulfurare a manganului electrolitic a fost studiat și s-a stabilit că prin tratarea topiturii cu calciu (în capsule de cupru sau nichel) este posibilă reducerea conținutului de sulf la 0,02 — 0,03 %.