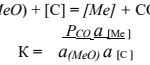Hidrogenul (semn H) este considerat cel mai ușor dintre toate gazele cunoscute. Acesta are o stare moleculară și o activitate chimică scăzută. În ciuda stabilității sale, formează multe legături și este prezent în mulți compuși diferiți. Aproape toate metalele și nemetalele reacționează cu el la temperaturi ridicate. De exemplu, hidrogenul gazos și oxidul de fier reacționează pentru a forma fier metalic și apă.
Conținut
Reacțiile hidrogenului cu metalele
Interacțiunea hidrogenului cu metalele nu este atât de simplă precum pare la prima vedere. Este important să subliniem că acesta reacționează exclusiv cu metalele alcaline și alcalino-pământoase. Acestea includ:
- litiu;
- sodiu;
- potasiu;
- rubidiu;
- franciu;
- cesiu, etc.
Atunci când interacționează cu elemente din grupa activă, H își reduce adesea gradul de oxidare, adică prezintă proprietăți oxidante. Acest lucru duce la formarea de hibrizi cu structură ionică. Numai atunci când reacționează cu elemente metalice active, H este un agent oxidant. În toate celelalte cazuri, este un agent reducător.
Caracteristici distincte ale interacțiunii
Interacțiunea metalelor cu hidrogenul se explică prin proprietățile și caracteristicile unice ale acestei substanțe. Reacția începe să se producă în condiții precum iradierea, o creștere semnificativă a temperaturii sau în prezența catalizatorilor. După cum s-a menționat mai sus, rezultatul final implică formarea de hibrizi. Acest lucru este bine văzut în reacția cu litiul: 2Li+2H2=2LiH.
O altă caracteristică a H este că elementul începe să reducă oxizii multor elemente metalice atunci când temperatura crește și alți parametri se modifică. Acest lucru duce la formarea apei: CuO+H2=H2O+Cu. Dar, în acest caz, H nu mai este un agent oxidant, ci un agent reducător.
Metal plus hidrogen este o schemă destul de posibilă, care se va desfășura în toate condițiile necesare controlate de specialiști. Dacă suprafețele metalelor nu interacționează cu H pentru a forma hibrizi stabili, canalizează recombinarea atomilor de hidrogen pentru a forma molecule de H și, astfel, sunt încălzite la limită chiar de energia care este eliberată în timpul reacțiilor. Astfel, aproape toate metalele și nemetalele reacționează cu hidrogenul la temperaturi ridicate.
Dar, la temperaturi și presiuni ridicate, H reduce oxizii majorității metalelor și multe săruri la nemetale. Un exemplu este reacția hidrogenului gazos cu fierul, rezultând apă și fier metalic.
Solubilitatea H în metale

Atunci când vorbim despre solubilitatea hidrogenului în metale, este important să subliniem că aceasta are loc la un nivel bun. Cel mai bine apare într-un element precum paladiul. O astfel de proprietate face posibilă luarea în considerare a sistemului de interacțiune dintre metal și hidrogen pentru stocarea și transportul ultimei substanțe.
Metalele oferă o regiune de interacțiune în care atomii de H pot exista și se pot mișca într-un anumit câmp de energie potențială. Absorbția H în compuși este determinată în mare măsură de entalpia soluției, în special de semnul acesteia, care indică dacă absorbția este exotermă sau endotermă.
Principiul și sistemul de interacțiune fier-hidrogen au fost utilizate pe scară largă în diverse domenii datorită proprietăților sale unice:
- metalurgia pulberilor;
- pompe de căldură;
- reactoare nucleare;
- separarea izotopilor;
- crearea de filtre de hidrogen;
- încetinirea reactoarelor nucleare;
- fabricarea de dispozitive pentru disocierea apei etc.