Un sistem bicomponent este un mecanism special, cu o bază biologică moleculară, prin care celulele pot simți și răspunde la orice modificări ale factorilor de mediu. Bacteriile îl au, și este vorba despre un set de câteva zeci de senzori care examinează condițiile locale și decid cum să răspundă cel mai bine la acestea.
Acest sistem și principiul său de funcționare au fost studiate timp de mulți ani. S-a descoperit că acest mecanism are anumite regularități și funcționează după reguli. Acestea au fost descrise de Willard Gibbs, un fizician și matematician american.
Cum sună regula lui Gibbs?

Regula fazei Gibbs pentru un sistem bicomponent oferă un cadru teoretic, bazat pe termodinamică, pentru caracterizarea stării chimice și prezicerea raporturilor de echilibru ale fazelor (minerale, topituri, aliaje, lichide, vapori) prezente în funcție de condițiile fizice precum presiunea și temperatura.
Sistemele care se află în echilibru termodinamic sunt de obicei considerate a fi izolate de mediul lor într-un recipient închis, dar multe structuri geologice pot fi considerate a se supune regulii fazelor. În plus, în sistemele bicomponente este posibil să se atingă echilibrul lichid-vapori, adică stări complet opuse.
Gibbs a exprimat toate acestea într-o formulare simplă:
- P este numărul de faze. Topiturile magmatice, lichidele (soluții apoase) și vaporii sunt considerate unice. Dar este demn de remarcat faptul că prezența a două sau mai multe faze în aceeași stare a materiei este foarte posibilă. De exemplu, un grup de minerale solide, lichide nemiscibile, cum ar fi cele cu următoarele componente: apă și carboni;
- F este numărul de grade de libertate;
- C este numărul minim de componente chimice necesare pentru a forma toate fazele.
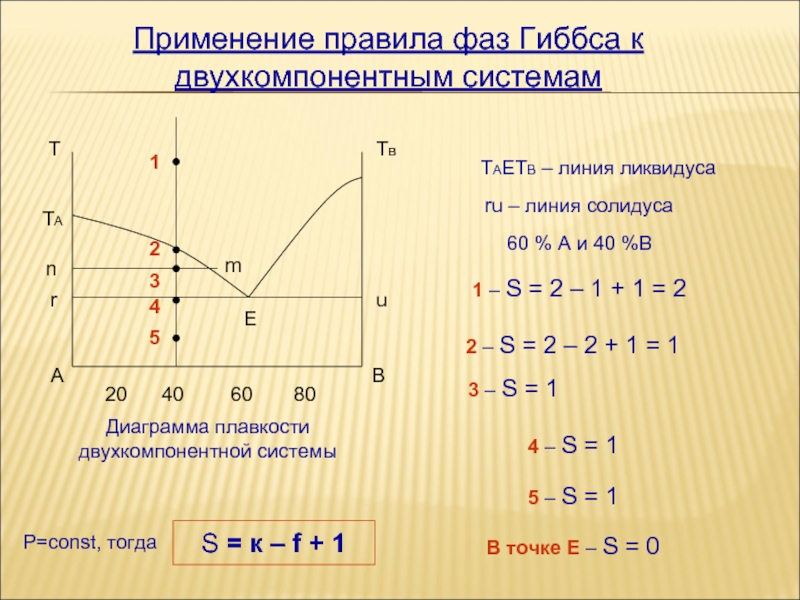
Echilibrul în sistemele bicomponente
Echilibrul fazelor în sistemele bicomponente implică prezența uneia sau mai multor faze, fiecare conținând una sau mai multe specii. În acest caz, proprietățile intensive vor avea anumite valori. Astfel, sistemul va rămâne în echilibru dacă există o modificare a numărului de faze fără o modificare a temperaturii, presiunii sau compoziției acestora.
Echilibrul este punctul de stabilitate termică, mecanică și de transport atunci când se modifică concentrația variabilelor intensive. De exemplu, o creștere sau o scădere a temperaturii, o creștere a presiunii.
Aplicarea regulii
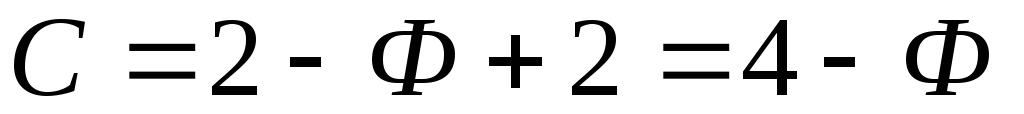
Cunoscând principiile și condițiile de echilibru între faze și utilizând regula lui Gibbs, este posibil să se cunoască caracteristicile stării chimice și să se prevadă raportul de echilibru al fazelor (minerale, topituri, lichide, vapori) care sunt prezente în funcție de condițiile fizice precum presiunea și temperatura. În plus, este posibil să se prevadă comportamentul unei substanțe sau al unui amestec în funcție de diferite variabile.
Regula este cel mai adesea utilizată în domenii precum metalurgia, ingineria chimică, medicina, construcțiile și știința materialelor. Ea este utilizată de specialiști în întreprinderi de diferite mărimi și pentru tot felul de scopuri.